
����Ŀ���ش���������
��1����pH���������������ҺA�����ᣩ��B��CH3COOH���քe��п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ����_____����д��ţ���
�ٿ�ʼ��Ӧʱ������A��B �ڲμӷ�Ӧ��п�����ʵ���A=B
�۷�Ӧ����Ҫ��ʱ��B��A ��A����пʣ��
��2����֪��CH3COOH�dz��������ᣬ���г�����0.1molL-1��CH3COOH��Һ��
���¶Ȳ��䣬��ˮϡ�����У����б���ʽ������һ����С����_____������ĸ��ţ���ͬ������������Һ�����¶ȣ����б���ʽ�������������_____��
A��c(H+) B��c(H+)��c(OH-)
C��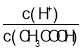 D��
D��![]()
��3��ȡ0.10mol CH3COOH�������ᣩ��������ʵ�飬����䵼����������ˮ���仯��ͼ��ʾ���Ƚ�a��b���������ʣ�������������������=������
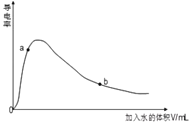
�� n(H+)��a_____b��
�� c(CH3COO-)��a_____b��
����ȫ�к�ʱ����NaOH�����ʵ�����a_____b��
��4��25��ʱ���������ʵĵ���ƽ�ⳣ�����±���ʾ��
CH3COOH | H2CO3 | HCN |
1.7��10��5 | K1=4.3��10-7 K2=5.6��10��11 | 4.9��10��10 |
��ش��������⣺
�� CH3COOH��H2CO3��HCN��������ǿ������˳��Ϊ_________��
�� ��¯ú����һ�㺬��H2S��HCN���壬�еĹ�������������£�ʹ��K2CO3��Һ����ú���е�H2S��HCN���壬ʵ���������衣������������ݣ����Դ��������Ʋ�ͬΪ0.l molL-1��K2CO3��Һ��HCN��Ϻ�����ܷ����ķ�Ӧ�����ӷ���ʽ_____��
���𰸡��ڢ� A ABCD �� �� = CH3COOH��H2CO3��HCN CO32- + HCN ![]() HCO3- + CN-
HCO3- + CN-
��������
��1����pH������ʹ�����Һ��������Ũ����ͬ�������Ũ��С��CH3COOH��Ũ�ȣ��������ȣ�����������ʵ�������������ʵ����࣬����п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�����������ͬ���õ�п�����ᷴӦ����㣬п����ᷴӦп���㣻
��2�����¶Ȳ��䣬��ˮϡ�����У�ƽ������뷽���ƶ���CH3COOH��Һ��c(H+)��c(CH3COO-)��c(CH3COOH)����С���¶Ȳ��䣬ˮ�����ӻ������ʹ�����볣�����䣻
�ڴ����ˮ�ĵ������Ϊ���ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)��c(CH3COO-)����c(CH3COOH)��С��ˮ�����ӻ������ʹ�����볣������
��3�������ǹ��ۻ����Һ̬�����в����������ƶ������ӣ�����Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���
��4������ƽ�ⳣ��Խ������Խǿ��
��1���ٵ�pH������ʹ�����Һ��������Ũ����ͬ����ʼ��Ӧʱ��������ȣ��ʢٴ���
�ڷų�������������ͬ���ɵ�ʧ������Ŀ�غ��֪�μӷ�Ӧ��п�����ʵ�����ȣ��ʢ���ȷ��
���������Һ�д��ڵ���ƽ�⣬��pH������ʹ�����Һ��п��Ӧʱ��������Һ��������Ũ�ȱ仯С��������Ũ��Խ��Ӧ����Խ�죬���ɵ�����������ʱ��Խ�٣��ʢ۴���
�ܵ�pH������ʹ�����Һ�������Ũ��С��CH3COOH��Ũ�ȣ��������ȣ�����������ʵ�������������ʵ����࣬����п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�����������ͬ���õ�п�����ᷴӦ����㣬п����ᷴӦп���㣬�ʢ���ȷ��
�ʴ�Ϊ�ڢܣ�
��2�����¶Ȳ��䣬��ˮϡ�����У�ƽ������뷽���ƶ���CH3COOH��Һ��c(H+)��c(CH3COO-)��c(CH3COOH)����С���¶Ȳ��䣬ˮ�����ӻ������ʹ�����볣�����䡣
A����ˮϡ�����У�c��H+����С����A��ȷ��
B����ˮϡ�����У�ˮ�����ӻ�����Kw= c(H+)��c(OH-)���䣬��B����
C��������볣��K=![]() ����Һ��
����Һ��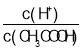 =
=![]() ����ˮϡ�����У�K���䣬c(CH3COO-)��С����
����ˮϡ�����У�K���䣬c(CH3COO-)��С����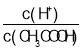 ����C����
����C����
D����ˮϡ�����У�������볣��K=![]() ���䣬��D����
���䣬��D����
�ʴ�ΪA��
�ڴ����ˮ�ĵ������Ϊ���ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)��c(CH3COO-)����c(CH3COOH)��С��ˮ�����ӻ������ʹ�����볣������
A�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)����A��ȷ��
B�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���ˮ�����ӻ�����Kw= c(H+)��c(OH-)����B��ȷ��
C�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���c(H+)����c(CH3COOH)��С����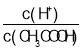 ����C��ȷ��
����C��ȷ��
D�����������ȹ��̣������¶ȣ�����ƽ������뷽���ƶ���������볣��K=![]() ����D��ȷ��
����D��ȷ��
�ʴ�ΪABCD��
��3���ٴ���Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���n(H+)������a��b���ʴ�Ϊ����
�ڴ���Ϊ���ᣬ��ˮϡ�ͣ�ƽ������뷽���ƶ���n(CH3COO-)����c(CH3COO-)��������С����ͼ��֪a��b���ʴ�Ϊ����
����Һϡ��ǰ�����ʵ����ʵ������䣬����ȫ�к�ʱ����NaOH�����ʵ�����ȣ��ʴ�Ϊ=��
��4���ٸ��ݱ������ݿ�֪����ĵ����ƽ�ⳣ����СΪCH3COOH��H2CO3��HCN��HCO3-������ƽ�ⳣ��Խ������Խǿ����������ǿ������˳��ΪCH3COOH��H2CO3��HCN���ʴ�ΪCH3COOH��H2CO3��HCN��
�ڸ��ݱ������ݿ�֪��������ǿ������˳��ΪCH3COOH��H2CO3��HCN��HCO3-����ǿ���������ԭ����֪��K2CO3��Һ��HCN��Ӧ����KCN��KHCO3����Ӧ�����ӷ���ʽΪCO32- + HCN![]() HCO3- + CN-���ʴ�ΪCO32- + HCN
HCO3- + CN-���ʴ�ΪCO32- + HCN![]() HCO3- + CN-��
HCO3- + CN-��


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������������Ӧ���ǣ� ��
A | B | C | D | |
ʵ�� |
|
|
|
|
���� | һ��ʱ���a��Һ�����b��Һ�� | ����KMnO4��Һ��ɫ | pH�Ʋ�â���pH���ڢ���pH | �Թܢ����д������ݣ��Թܢ��������� |
���� | a�ܷ���������ʴ��b�ܷ������ⸯʴ | ����ϩ���ɿ���ʹ����KMnO4��Һ��ɫ | �����ԣ�Mg��Al | ���ԣ����̼����� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͬ��������������������a�г���NO2(g)����ɫ���ٱ仯����������b�г�����������ʹ����������ɫ�������ȡ�ע�⣺ͬŨ�ȵ�NO2��Br2������ɫ��ͬ��2NO2(g)![]() N2O4(g)(��ɫ)��Ѹ�ٽ�������ͬʱѹ��(�������岻Һ��)������˵����ȷ����
N2O4(g)(��ɫ)��Ѹ�ٽ�������ͬʱѹ��(�������岻Һ��)������˵����ȷ����
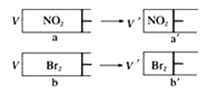
A.a��a�������У���ɫͻȻ���Ȼ����dz��������ɫ��ԭ����dz
B.����a��b�Լ������ٶȻ���ѹ������a��b����ɫ�������������ÿһ����ͬ��ʱ��㣬b����ɫ�ܱ�a����
C.���������ͻ�����Ϊ��ɫ�����������۲�a��a����a������ɫ��adz
D.��������ʵ�����naһ������nb��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦFeO(s)��CO(g) Fe(s)��CO2(g)��700 ��ʱƽ�ⳣ��Ϊ0.68��900��ʱƽ�ⳣ��Ϊ0.46������˵����ȷ����
A. �����¶ȸ÷�Ӧ������Ӧ���������淴Ӧ���ʼ�С
B. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��![]()
C. ����CO2Ũ�ȣ�ƽ�ⳣ������
D. �÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������mgijX2���壬����Ħ������ΪM g/mol�������ӵ�������NA��ʾ����
��1������������ʵ���Ϊ________mol��
��2��һ��Xԭ�ӵ�����_________g��
��3���������ڱ�״���µ����Ϊ________L��
��4������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ________mol��L��1��
��5������������1Lˮ��(�����Ƿ�Ӧ)��������Һ���ܶ�Ϊ��g/cm3�������Һ�����ʵ���Ũ��Ϊ__________mol��L��1��
��6����ͬ״���£���X2�뵪���������1:4��ϣ��û��������������ܶ�Ϊ14.4��X2����Է�������Ϊ_______��
��7���������X2���ܶ�Ϊ1.25 g/L��Xԭ���������_____�����ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȱ���ӻ�������ָ������������·��˹�ṹ��һ��ԭ��ͨ����������ʹ��۲�������ﵽ8��Hԭ�Ӵﵽ2���γɵ��ȶ����ӽṹ��Ҫ���һ��������˵���������
A.NH3��BF3��BF4-��ֻ��BF3��ȱ���ӻ�����
B.BF3��BF4-����ԭ�ӵ��ӻ���ʽ�ֱ�Ϊsp2��sp3
C.BF3��NH3��Ӧʱ����λ������
D.BF4-�ļ���С��NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ﮣ����������һ�ֿɳ�ŵ�أ���ط�ӦΪ2Li + O2 = Li2O2��ijﮣ�������صĹ���ԭ��ͼ���¡�����˵����ȷ����
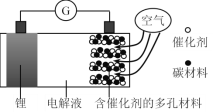
A.��ѡ���л����Һ��ˮ�Ե��Һ
B.�������Ķ�缫Ϊ��صĸ���
C.�ŵ�ʱ�����ĵ缫��ӦʽΪO2 + 2Li+ + 2e��= Li2O2
D.���ʱ﮵缫Ӧ������ӵ�Դ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ������п[Zn3(PO4)2��4H2O��Ħ������Ϊ457 g��mol��1��������ˮ] ��һ��������������ɫ�����������ϡ�ʵ������п�ң���ZnO��PbO��CuO��FeO��Fe2O3��SiO2�ȣ�Ϊԭ���Ʊ�Zn3(PO4)2��4H2O���������£��ش��������⣺
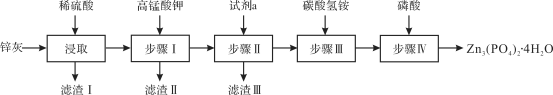
��֪��6NH4HCO3 + 3ZnSO4 ![]() ZnCO3��2Zn(OH)2��H2O�� + 3(NH4)2SO4 + 5CO2��
ZnCO3��2Zn(OH)2��H2O�� + 3(NH4)2SO4 + 5CO2��
ZnCO3��2Zn(OH)2��H2O + 2H3PO4 ![]() Zn3(PO4)2��4H2O + 2H2O + CO2��
Zn3(PO4)2��4H2O + 2H2O + CO2��
��1�����������Ҫ�ɷ�Ϊ________��������У����Ƚ���Һ��pH����5.1����ʱӦѡ�������Լ���________��
a����ˮ b���������� c������п d����������
�μ�KMnO4��Һ����MnO2���ɣ��÷�Ӧ�����ӷ���ʽΪ________���Լ�aΪ________���������Ӧ�����õ�Zn3(PO4)2��4H2O�IJ�������________���
��2����ȡ45.7 mg Zn3(PO4)2��4H2O�������ط������������������¶ȵı仯��ϵ��ͼ��ʾ��Ϊ���Zn3(PO4)2��2H2O��Zn3(PO4)2��H2O�Ļ�ϲ�Ʒ�����ʱ���¶ȷ�ΧΪ________��
a��90��145�� b��145��195�� c��195��273�� d����273��
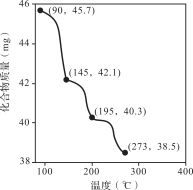
��3��Ϊ�ⶨ��Ʒ��Zn3(PO4)2��4H2O�ĺ�������������ʵ�飬��֪�ζ�������Zn2+��H2Y2��1:1��Ӧ��
�����ȷ��ȡ0.4570 g��Ʒ���ձ��У�������������ʹ���ܽ⣬����Һת����100 mL����ƿ�����ݡ�
�������ȡ20.00 mL������Һ����ƿ�У�����ָʾ������pH = 5��6�Ļ�����Һ����0.02000mol��L��1 Na2H2Y����Һ�ζ����յ㣬���Na2H2Y����Һ������Ϊ27.60 mL��
���������ȡ��Һʱ��ʹ�õIJ�������Ϊ________����Ʒ��Zn3(PO4)2��4H2O����������Ϊ_______�����в����У����²�Ʒ��Zn3(PO4)2��4H2O�����ⶨֵƫ�͵���________��
a������I�ж���ʱ���ӿ̶���
b������I��ת����Һʱδϴ���ձ�
c������II�еζ���δ��Na2H2Y����Һ��ϴ
d������II�еζ�ǰ�ζ����������ݣ��ζ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ˮ�ĵ���ƽ������ͼ��ʾ������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�������100��ʱ��ˮ�ĵ���ƽ��״̬��B��
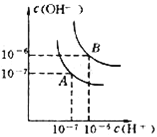
��1����100��ʱ��Kw����ʽΪ_______���ڴ��¶��£�kwΪ___.
��2���������£���pH=9��Ba��OH��2��Һ��pH=5��ϡ�����ϣ���ʹ�����ҺpH=7��Ba��OH��2������������Ϊ____��
��3������ʱ��PHΪ3��������Һϡ��100����ϡ�ͺ���Һ�У�C��SO42-����C��H+��֮��ԼΪ___��
II.���Т�CH3COOH ��HCl ��H2SO4������Һ������Ҫ��ش��������⣺
��1��д���ٵĵ��뷽��ʽ_______.
��2��������pH��ͬʱ�������ʵ���Ũ��������___������ţ���
��3�������ǵ����ʵ���Ũ����ͬʱ����pH��С��___������ţ���
��4���������£���c��H+����Ϊ0.01mol/L��������ֱ��ˮϡ����ԭ����10����c��H+���ɴ�С��˳��Ϊ___������ţ�.
��5����������ʵ���Ũ�Ⱦ���ͬ�Ģ٢ڢ���������Һ���ֱ�����ͬŨ�ȵ��ռ���Һǡ����ȫ��Ӧ�������ռ�������Ϊ____��
��6�������pH��ͬʱ�����ĵ�����Zn����������������С��ϵΪ___������ţ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com