
【题目】缺电子化合物是指电子数不符合路易斯结构(一个原子通过共享电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是
A.NH3、BF3、BF4-中只有BF3是缺电子化合物
B.BF3、BF4-中心原子的杂化方式分别为sp2、sp3
C.BF3与NH3反应时有配位键生成
D.BF4-的键角小于NH3
【答案】D
【解析】
A. NH3电子式为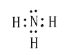 符合路易斯结构,BF3电子式为
符合路易斯结构,BF3电子式为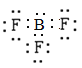 ,B原子价层电子数为6,不符合路易斯结构、BF4-电子式为
,B原子价层电子数为6,不符合路易斯结构、BF4-电子式为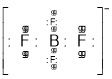 ,只有BF3是缺电子化合物,故A正确;
,只有BF3是缺电子化合物,故A正确;
B. BF3中心原子B价层电子对数为![]() ,则杂化方式为sp2杂化;BF4-中心原子B价层电子对数为
,则杂化方式为sp2杂化;BF4-中心原子B价层电子对数为![]() ,则杂化方式分别为sp3杂化,故B正确;
,则杂化方式分别为sp3杂化,故B正确;
C. BF3与NH3反应时,NH3中N原子有孤电子对,BF3中B有空轨道,可生成配位键,故C正确;
D. BF4-和NH3均为sp3杂化, BF4-中心原子无孤电子对,NH3有一对孤电子对,根据价层电子对互斥理论,孤电子对数增多,对成键电子的斥力增大,键角减小,则BF4-的键角大于NH3,故D错误;
故答案选:D。


科目:高中化学 来源: 题型:
【题目】25℃下,水中碳酸化合物的三种微粒占总浓度的百分比随pH变化如图所示。25℃时,向10mL0.1molL-lNa2CO3溶液中逐滴加入0.1molL-1稀盐酸,下列说法正确的是( )

A.0.1molL-lNa2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.溶液pH=8.3时,c(Na+)=c(C1-)
C.溶液pH=7时,加入盐酸体枳大于10mL
D.溶液pH=6时的导电能力强于pH=11时的导电能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。
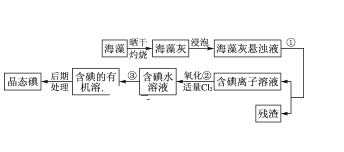
(1)指出提取碘的过程中有关的实验操作名称___、___。
(2)写出流程图中氧化②的离子反应议程式___。
(3)提取碘的过程中,可供选择的有机试剂是___。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是___。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。
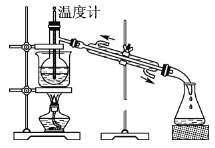
①____;
②____;
③____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)等pH、等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①开始反应时的速率A>B ②参加反应的锌的物质的量A=B
③反应所需要的时间B>A ④A中有锌剩余
(2)已知,CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
①温度不变,加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同),②若该溶液升高温度,下列表达式的数据增大的是_____。
A.c(H+) B.c(H+)·c(OH-)
C.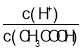 D.
D.![]()
(3)取0.10mol CH3COOH(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
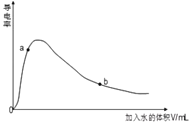
① n(H+):a_____b;
② c(CH3COO-):a_____b;
③完全中和时消耗NaOH的物质的量:a_____b;
(4)25℃时,部分物质的电离平衡常数如下表所示:
CH3COOH | H2CO3 | HCN |
1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 4.9×10﹣10 |
请回答下列问题:
① CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_________。
② 焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。请根据上述数据,尝试从理论上推测同为0.l molL-1的K2CO3溶液和HCN混合后,最可能发生的反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1个氧气分子体积为 ![]() cm3
cm3
B.铜电解精炼时,当阳极质量减少64 g时,电路中转移电子数为2NA
C.标准状况下22.4 L Cl2完全溶于水时,所得溶液中含氯微粒总数为2NA
D.NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
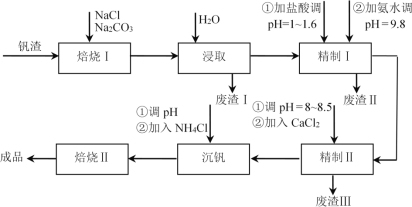
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO![]() +4H+=Al3++2H2O。
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)用________取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴___作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的___________(填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为_________mL。

(4)滴定。当______________________________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=_____________g/100mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com