
【题目】25℃下,水中碳酸化合物的三种微粒占总浓度的百分比随pH变化如图所示。25℃时,向10mL0.1molL-lNa2CO3溶液中逐滴加入0.1molL-1稀盐酸,下列说法正确的是( )

A.0.1molL-lNa2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.溶液pH=8.3时,c(Na+)=c(C1-)
C.溶液pH=7时,加入盐酸体枳大于10mL
D.溶液pH=6时的导电能力强于pH=11时的导电能力
【答案】C
【解析】
A. 根据电荷守恒,0.1molL-lNa2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),A错误;
B. 根据图像,溶液pH=8.3时,溶液中溶质为碳酸氢钠和氯化钠,c(Na+)>c(C1-),B错误;
C. 当加入盐酸体积为10mL时,碳酸钠与盐酸恰好反应生成碳酸氢钠和氯化钠,溶液显碱性,pH>7,若使溶液pH=7,溶液中加入盐酸体枳大于10mL,C正确
D. 溶液中离子浓度越大,导电能力越强;离子所带电荷数越高,导电能力越强,根据图像可知,溶液pH=11时的导电能力强于pH=6时的导电能力,D错误;故答案为:C。


科目:高中化学 来源: 题型:
【题目】有Al2(SO4)3和K2SO4的混合溶液200mL,将它均分成两份。一份滴加足量氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO42﹣完全沉淀。反应中消耗a mol NH3H2O、b mol BaCl2.据此得知原混合溶液中的c(K+)为( )
A. (20b﹣10a)molL﹣1B. ![]() molL﹣1
molL﹣1
C. (10b﹣5a)molL﹣1D. ![]() molL﹣1
molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸是一种绿色生态杀菌剂,结构简式为 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式![]()
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2![]() CH3COOOH+H2O
CH3COOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,X、Y、Z、P分别为构成生物大分子的基本单位,请回答下列问题:

(1)Ⅰ在小麦种子中主要是指________,其单体X为_________是细胞生命活动所需的主要能源物质。
(2)物质Ⅲ是_______,其元素组成有___________等。
(3)在细胞中含量最高的有机物是___________(填字母),它能与双缩脲试发生作用,产生_____色反应。(4)物质Y是___________,组成Ⅱ的Y有4种,Y的种类与组成它的_________种类有关。
(5)细胞内良好的储能物质是_______,它属于脂质,脂质还有两类物质,其中________是细胞膜及细胞器膜等的重要成分,而固醇包括胆固醇、________和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如图:
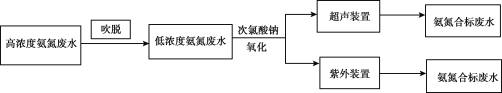
(1)吹脱法除氨氮:水中的氨氮大多数以NH4+和游离态的NH3保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移。从而达到脱除氨的目的。氨氮废水中NH3和NH4+平衡态的平衡关系有___。
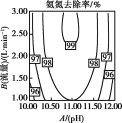
(2)温度、pH值、空气流量对脱除氨有很大的影响。pH值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,10<pH<11时,吹脱率随着pH增加而增加,请用化学平衡移动原理解释原因___。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是___。
II.对于含有H2PO4-的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生OH-,在通入O2的情况,又产生H2O2,以氧化水中的NH4+,同时NH4+还可以通过生成MgNH4PO46H2O沉淀而持续被除去。
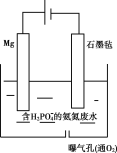
(1)阳极的电极反应式是___。
(2)废水中的NH4+'转化为MgNH4PO46H2O的离子方程式是___。
(3)pH大于10.5不利于MgNH4PO46H2O的生成,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。可用电解LiCl溶液制备LiOH,装置如图所示。下列说法正确的是
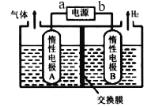
A.惰性电极B是阳极
B.电流流向为a→A→B→b
C.该电解池用的交换膜是阴离子交换膜
D.阳极发生的电极反应方程式:4OH- - 4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缺电子化合物是指电子数不符合路易斯结构(一个原子通过共享电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是
A.NH3、BF3、BF4-中只有BF3是缺电子化合物
B.BF3、BF4-中心原子的杂化方式分别为sp2、sp3
C.BF3与NH3反应时有配位键生成
D.BF4-的键角小于NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com