
【题目】反应FeO(s)+CO(g) Fe(s)+CO2(g),700 ℃时平衡常数为0.68,900℃时平衡常数为0.46。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为:![]()
C. 增大CO2浓度,平衡常数增大
D. 该反应的正反应是放热反应
科目:高中化学 来源: 题型:
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
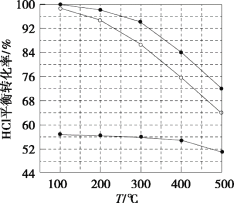
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图转化关系(反应条件略去)。已知X、Y、Z均为双原子单质,X是空气中含量最多的气体,甲可使湿润的酚酞试纸变红,乙溶于水即得盐酸。请完成下列问题:

(1)X的电子式是_________________。
(2)写出甲和乙反应的化学方程式__________________。
(3)实验室可用如图所示的装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出收集甲的仪器装置简图。_______________
②试管中的试剂是________________(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。
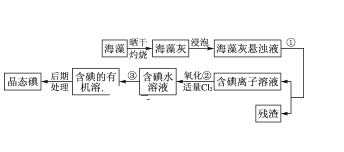
(1)指出提取碘的过程中有关的实验操作名称___、___。
(2)写出流程图中氧化②的离子反应议程式___。
(3)提取碘的过程中,可供选择的有机试剂是___。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是___。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。
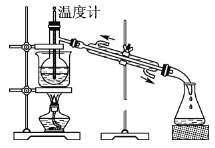
①____;
②____;
③____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由K2CO3、NaNO2、FeCl3、KClO3、AgNO3混合而成,为检验它的成分,做了如下实验:取固体加入足量的稀硝酸中,搅拌充分反应,得到无色透明溶液,同时有黄绿色气体和白色沉淀生成![]() 已知NaNO2不能被稀硝酸氧化)。根据以上实验现象,你认为以下判断正确的是
已知NaNO2不能被稀硝酸氧化)。根据以上实验现象,你认为以下判断正确的是
A.一定含有KClO3、AgNO3、NaNO2,不能肯定是否含有氯化铁
B.一定含有KClO3,且在反应过程中被还原生成了两种还原产物
C.另取适量固体加水溶解,若出现白色沉淀,即可证明K2CO3的存在
D.将反应产生的气体通入少量澄清石灰水,若有无沉淀出现,即可证明K2CO3不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)等pH、等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①开始反应时的速率A>B ②参加反应的锌的物质的量A=B
③反应所需要的时间B>A ④A中有锌剩余
(2)已知,CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
①温度不变,加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同),②若该溶液升高温度,下列表达式的数据增大的是_____。
A.c(H+) B.c(H+)·c(OH-)
C.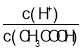 D.
D.![]()
(3)取0.10mol CH3COOH(冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
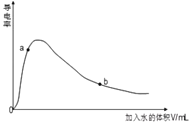
① n(H+):a_____b;
② c(CH3COO-):a_____b;
③完全中和时消耗NaOH的物质的量:a_____b;
(4)25℃时,部分物质的电离平衡常数如下表所示:
CH3COOH | H2CO3 | HCN |
1.7×10﹣5 | K1=4.3×10-7 K2=5.6×10﹣11 | 4.9×10﹣10 |
请回答下列问题:
① CH3COOH、H2CO3、HCN的酸性由强到弱的顺序为_________。
② 焦炉煤气中一般含有H2S和HCN气体,有的工厂在真空条件下,使用K2CO3溶液吸收煤气中的H2S和HCN气体,实现脱硫脱氰。请根据上述数据,尝试从理论上推测同为0.l molL-1的K2CO3溶液和HCN混合后,最可能发生的反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是体心立方堆积,关于钠晶体,下列判断合理的是 ( )
A. 其熔点比金属铝的熔点高
B. 一个钠的晶胞中,平均含有4个钠原子
C. 该晶体中的自由电子在外加电场作用下可发生定向移动
D. 该晶体中的钠离子在外加电场作用下可发生定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中,设计合理的是
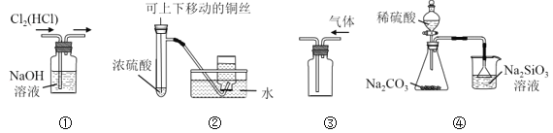
A. 图①用于除去Cl2中混有的HCl气体
B. 图②用于制取并收集少量SO2气体
C. 图③用于排空气法收集CO2气体
D. 图④比较硫、碳、硅三种元素的非金属性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com