
【题目】有一固体混合物,可能由K2CO3、NaNO2、FeCl3、KClO3、AgNO3混合而成,为检验它的成分,做了如下实验:取固体加入足量的稀硝酸中,搅拌充分反应,得到无色透明溶液,同时有黄绿色气体和白色沉淀生成![]() 已知NaNO2不能被稀硝酸氧化)。根据以上实验现象,你认为以下判断正确的是
已知NaNO2不能被稀硝酸氧化)。根据以上实验现象,你认为以下判断正确的是
A.一定含有KClO3、AgNO3、NaNO2,不能肯定是否含有氯化铁
B.一定含有KClO3,且在反应过程中被还原生成了两种还原产物
C.另取适量固体加水溶解,若出现白色沉淀,即可证明K2CO3的存在
D.将反应产生的气体通入少量澄清石灰水,若有无沉淀出现,即可证明K2CO3不存在
【答案】B
【解析】
取固体加入足量的稀硝酸中,搅拌,充分反应,得到无色透明溶液,则一定不含FeCl3;同时有黄绿色气体和白色沉淀生成![]() 已知NaNO2不能被稀硝酸氧化),只能是酸性溶液中KClO3把NaNO2氧化为NaNO3,本身被还原为黄绿色气体氯气,则一定含有KClO3,同时有白色沉淀生成,该白色沉淀一定是AgCl,则一定含有AgNO3,则KClO3氧化NaNO2时,同时被还原为Cl-,不确定K2CO3是否存在,以此来解答。
已知NaNO2不能被稀硝酸氧化),只能是酸性溶液中KClO3把NaNO2氧化为NaNO3,本身被还原为黄绿色气体氯气,则一定含有KClO3,同时有白色沉淀生成,该白色沉淀一定是AgCl,则一定含有AgNO3,则KClO3氧化NaNO2时,同时被还原为Cl-,不确定K2CO3是否存在,以此来解答。
由以上分析知,该固体中一定含有KClO3、NaNO2、AgNO3,一定不含有FeCl3,不确定K2CO3是否存在,
A. 一定含有KClO3、AgNO3、NaNO2,一定不含有FeCl3,故A错误;
B. 一定含有KClO3,且在反应过程中被还原生成了两种还原产物氯气和Cl-,故B正确;
C. 另取适量固体加水溶解,KClO3氧化NaNO2,自身被还原为Cl-,Cl-与Ag+反应生成AgCl白色沉淀,则不能证明K2CO3的存在,故C错误;
D. 反应产生的气体含有氯气,氯气可与水反应生成盐酸,盐酸可与澄清石灰水发生中和反应,因此即使气体中含有CO2,也不会有碳酸钙沉淀生成,因此不能证明K2CO3是否存在,故D错误;
故选B。


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式不正确的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物,说法不正确的是
A.氮气是空气中含量最高的气体,性质比较稳定
B.人工固氮需要在高温高压催化剂的条件下进行,但这是个放热反应
C.工业硝酸往往会发黄,因为其中含有Fe3+
D.常温下,浓硝酸可以利用铁罐车进行运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个相同带活塞的容器,向容器a中充入NO2(g)待颜色不再变化,再向容器b中充入溴蒸汽,使两容器的颜色和体积相等〔注意:同浓度的NO2和Br2蒸汽颜色相同,2NO2(g)![]() N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
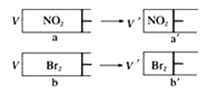
A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.若对a和b以极慢的速度缓缓压缩,则a和b的颜色均慢慢加深,但在每一个相同的时间点,b的颜色总比a的深
C.假设容器和活塞均为无色,从容器左侧观察a和a′,a′的颜色比a浅
D.气体的物质的量:na一定大于nb′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用18mol/L 的浓硫酸配制80mL3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④检漏、转移、洗涤 ⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是___mL,量取浓硫酸所用的量筒的规格是___(用下列编号填空)。
A.10 mL B.25mL C.50mL D.100mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用___向容量瓶中滴加蒸馏水至凹液面和刻度线相切为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水___;
②在转入容量瓶前烧杯中溶液未冷却至室温___;
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应FeO(s)+CO(g) Fe(s)+CO2(g),700 ℃时平衡常数为0.68,900℃时平衡常数为0.46。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为:![]()
C. 增大CO2浓度,平衡常数增大
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种可充放电池,电池反应为2Li + O2 = Li2O2,某锂-空气电池的构造原理图如下。下列说法正确的是
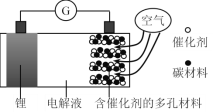
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时正极的电极反应式为O2 + 2Li+ + 2e-= Li2O2
D.充电时锂电极应连接外接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
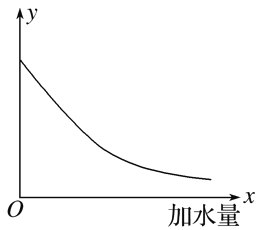
A. 溶液中H+的物质的量
B. 溶液中的c(CH3COO-)/c(CH3COOH)
C. 溶液的导电能力
D. CH3COOH的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com