
����Ŀ��ij������ȤС����Ҫ��18mol/L ��Ũ��������80mL3.0mol/L ϡ�����ʵ�鲽�����£��ټ�������Ũ�������� ����ȡһ�������Ũ���� ��ϡ�� �ܼ�©��ת�ơ�ϴ�� �ݶ��ݡ�ҡ�ȡ��ش��������⣺
��1������Ũ����������___mL����ȡŨ�������õ���Ͳ�Ĺ����___�������б����գ���
A��10 mL B��25mL C��50mL D��100mL
��2���ڢݲ�ʵ��IJ����Ǽ���������ƿ��ע������ˮ����̶���1-2cm��������___������ƿ�еμ�����ˮ����Һ��Ϳ̶�������Ϊֹ������ƿ������תҡ�Ȳ�װ�Լ�ƿ��
��3����������������Ƶ�ϡ����Ũ���к�Ӱ�죿������ƫ������ƫС��������Ӱ������
������ƿ������ˮϴ�Ӻ������������ˮ___��
����ת������ƿǰ�ձ�����Һδ��ȴ������___��
��ȡ��Ũ�����ϴ����Ͳ������ϴ��Һ�����ձ�___��
���𰸡�16.7 B ��ͷ�ι� ��Ӱ�� ƫ�� ƫ��
��������
��1������80mL 3.0 mol/Lϡ���ᣬ��Ҫѡ��100 mL������ƿ������ϡ����c2V1=c2V2�����Ũ������������Ũ��������ѡ����Ͳ�Ĺ��
��2�����ݶ��ݲ����������з�����
��3������c=![]() �������
�������
��1������80mL 3.0 mol/Lϡ���ᣬ��Ҫѡ��100 mL������ƿ�������Ҫ18 mol/LŨ��������Ϊ![]() ����Ͳ��ѡ��Ϊ������������ѡ��25 mL��Ͳ��
����Ͳ��ѡ��Ϊ������������ѡ��25 mL��Ͳ��
��2�����ݲ���Ϊ:����������ƿע������ˮ����̶���1��2 cm�������ý�ͷ�ι�������ƿ�μ�����Һ����̶������У�
��3��������ƿ������ˮϴ�Ӻ������������ˮ����Ϊ����ʱ����Ҫ��������ˮ�����Բ�Ӱ�����ƽ����
����ת������ƿǰ�ձ�����Һδ��ȴ�����£���������������ԭ���������С��Ũ��ƫ��
��ȡ��Ũ�����ϴ����Ͳ������ϴ��Һ�����ձ���������ȡŨ���������������ս��ƫ��


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����������ʵ������������������һ����
ѡ�� | ʵ����������� | ʵ����� |
A | ��ij��Һ�м��� | ����Һ��һ������ |
B | ��ij��Һ�м���ϡ���ᣬ����ɫ������� | ����Һ��һ������ |
C | ��ij��Һ�м��� | ����Һ��һ������ |
D | ��ij��Һ�м����̪��Һ����Һ��Ϊ��ɫ | ����Һ��һ������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij��ѧС��̽����������Һ�����ʡ�
װ�� | ʵ����� | ʵ����� | ʵ������ |
| ʵ��I | ���Թ��еμ�2%��ˮ�������� | �����غ�ɫ�����������μӳ�����ʧ |
ʵ��II | 1.���Թ��м���0.1mol��L-lNaOH��Һ1mL 2.�����μ�3%H2O2������ | 1.�����غ�ɫ���� 2.����������ɫ��ζ���壬�к�ɫ�������� | |
ʵ��III | 1.���Թ��еμ�1mL0.1molL-1KI��Һ 2.ȡ�����ϲ���Һ���Թܼ��У����������Һ | 1.������ɫ���� 2.��Һ�����Ա仯 |
��֪��AgOH��һ�ְ�ɫ���壬�����¼����ȶ����ֽ�Ϊ�غ�ɫ������ˮ������������
��1�������£�0.1mo1L-1AgNO3��ҺpHԼΪ4���������ӷ���ʽ����ԭ��___��
��2��ʵ��I�У���Ӧ�Ļ�ѧ����ʽ��___��
��3��ʵ��II�У������飬��ɫ�����ijɷ�ΪAg����Ag�����Ļ�ѧ����ʽ��___�����ⶨ��ʵ��������������ԶԶ���ڸ÷�Ӧ������ֵ�����ܵ�ԭ����___��
��4��ʵ���У�������ɫ���������ӷ���ʽ��___����ͬѧ���룬I-�л�ԭ�ԣ�Ag+�������ԣ�AgNO3��Һ��KI��ҺӦ�ÿ��Է���������ԭ��Ӧ�����������ͼԭ��أ���ʵ��IV֤���˲�����������У���A�ձ��У�ʯī�缫�����������������ֹ���������Ϊ�����ʡ�����Һ��___������B�ձ��в���IJ�����������___����������ԭ��Ӧ�����ӷ���ʽ��__��

��5���Ա�ʵ��III��ʵ��IV��ʵ��III��I2���ɵĿ���ԭ����___��д����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S���ֽ������ͨ��CO2��CH4�ᷢ�����·�Ӧ������˵������ȷ����
A.CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)ѹ�����������ƽ��ת���ʽ�����
2H2(g)+2CO(g)ѹ�����������ƽ��ת���ʽ�����
B.H2S(g)+CO2(g)![]() H2O(g)+COS(g)ͨ��CO2�����ٽ���Ӧ�Ľ���
H2O(g)+COS(g)ͨ��CO2�����ٽ���Ӧ�Ľ���
C.��֪2H2S(g)+CH4(g)![]() 4H2(g)+CS2(g) ��H��0����÷�Ӧ�ڸ��������Է�
4H2(g)+CS2(g) ��H��0����÷�Ӧ�ڸ��������Է�
D.2H2S(g)![]() 2H2(g)+S(g) ��H��0
2H2(g)+S(g) ��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������������K2CO3��NaNO2��FeCl3��KClO3��AgNO3��϶��ɣ�Ϊ�������ijɷ֣���������ʵ�飺ȡ�������������ϡ�����У������ַ�Ӧ���õ���ɫ����Һ��ͬʱ�л���ɫ����Ͱ�ɫ��������![]() ��֪NaNO2���ܱ�ϡ��������������������ʵ����������Ϊ�����ж���ȷ����
��֪NaNO2���ܱ�ϡ��������������������ʵ����������Ϊ�����ж���ȷ����
A.һ������KClO3��AgNO3��NaNO2�����ܿ϶��Ƿ����Ȼ���
B.һ������KClO3�����ڷ�Ӧ�����б���ԭ���������ֻ�ԭ����
C.��ȡ���������ˮ�ܽ⣬�����ְ�ɫ����������֤��K2CO3�Ĵ���
D.����Ӧ����������ͨ����������ʯ��ˮ�������������֣�����֤��K2CO3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij������A������Ԫ����ɣ����Է������µ�ת����
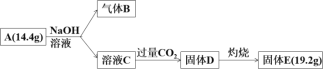
��֪����״���£�����B���ܶ���������8������ش�
��1�����A��Ԫ����_________��A�Ļ�ѧʽ��_________
��2����д��A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ_________
��3��A�����ڽ�����ұ������д��A��Fe2O3�Ļ�ѧ��Ӧ����ʽ_________
��.ijʵ��С����������ʵ�飺

��ش�
��1��д��Ӳ�ʹ��з�����Ӧ�Ļ�ѧ����ʽ��_________
��2����ͬѧ��Ϊ�Ҵ��Ĵ�������Ӧ�����к������ᣬ�����ʵ��������ɷ֣�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ˮú�����״����Ҵ��ȶ�����Ҫ�Ļ���ԭ�ϡ�
��1��ˮú������ԭ���ǣ�C(s)+H2O(g) ![]() CO(g)+ H2(g) ��H = +131.3kJ��mol-1��
CO(g)+ H2(g) ��H = +131.3kJ��mol-1��
����˵���÷�Ӧ�ﵽƽ��״̬����______������ĸ����
A��v��(CO)= v��(H2) B��c(CO)=c(H2)
C�����������У������ܶȲ��� D�����������У�����ѹǿ����
�ڸ÷�Ӧ�ﵽ��ѧƽ��ʱ����Ҫ����ˮ������ת���ʿɲ�ȡ�Ĵ�ʩ��____������ĸ����
A������̼�����ʵ��� B������ˮ���������ʵ���
C������ѹǿ D�������¶�
��2����֪��CO(g)+ 2H2 (g)![]() CH3OH(g)�������ʵ����� CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��������������ݻ�ѹ��Ϊԭ����һ�루�����������䣩����ƽ����ϵ������Ӱ����______������ĸ����
CH3OH(g)�������ʵ����� CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��������������ݻ�ѹ��Ϊԭ����һ�루�����������䣩����ƽ����ϵ������Ӱ����______������ĸ����
A��c( H2 )���� B��CH3OH �����ʵ������� C������ƽ��ʱ![]() ��С
��С
��3����֪6H2(g)��2CO2(g) ![]() CH3CH2OH(g)��3H2O(g) �����¶�ΪT�棬�ݻ�������ܱ������У���3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������Ϊa��
CH3CH2OH(g)��3H2O(g) �����¶�ΪT�棬�ݻ�������ܱ������У���3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������Ϊa��
�ٴﵽƽ��ʱ��ת������(H2)����(CO2) = ______��
�ں����£�����������г���2mol He����H2��ת����______������������ ������С�� ��������������
����T�棬�ݻ��ɱ���ܱ������н�3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������_______a���������� �������� ����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С����Ҫ1 molL��1��CuSO4 ��Һ80 mL�����õ�����CuSO4��5H2O�������ƣ���ش��������⣺
��1�����ȡ���� ______g��
��2�����ƹ����У�����Ҫ������������ţ�________��
A��ҩ�� B���ƾ��� C��������ƽ D���ձ� E�������� F��������
�������ʵ�黹ȱ�ٵ�������________��
��3�������ƹ����У����в���������������ҺŨ��ƫ�͵���_____������ţ���
��ת��ǰ������ƿ�к�����������ˮ ��ת��ʱ������Һ�彦��
�۶���ʱ�����ӿ̶��� �� �ܵߵ�ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com