
【题目】H2S催化分解过程中通入CO2、CH4会发生如下反应,下列说法不正确的是
A.CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大
2H2(g)+2CO(g)压缩容器体积,平衡转化率将增大
B.H2S(g)+CO2(g)![]() H2O(g)+COS(g)通入CO2,将促进反应的进行
H2O(g)+COS(g)通入CO2,将促进反应的进行
C.已知2H2S(g)+CH4(g)![]() 4H2(g)+CS2(g) △H>0,则该反应在高温下易自发
4H2(g)+CS2(g) △H>0,则该反应在高温下易自发
D.2H2S(g)![]() 2H2(g)+S(g) △H>0
2H2(g)+S(g) △H>0
科目:高中化学 来源: 题型:
【题目】二甲醚(![]() )是一种清洁能源,可由合成气(
)是一种清洁能源,可由合成气(![]() 、
、![]() )来制备,反应原理如下:
)来制备,反应原理如下:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
回答下列问题:
(1)上述反应符合“原子经济性”原则的是__________(填“反应Ⅰ”或“反应Ⅱ”)。
(2)图中使曲线![]() 对应反应按曲线
对应反应按曲线![]() 进行的措施是__________,由合成气(
进行的措施是__________,由合成气(![]() 、
、![]() )制备
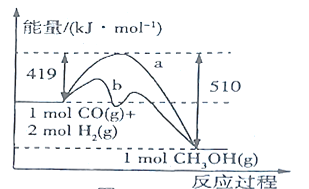
)制备![]() 的热化学方程式为__________,该反应自发进行的条件为_________(填“低温”或“高温”)。
的热化学方程式为__________,该反应自发进行的条件为_________(填“低温”或“高温”)。
(3)模拟该制备原理,起始时在某容器中充入![]() 和
和![]() 合成
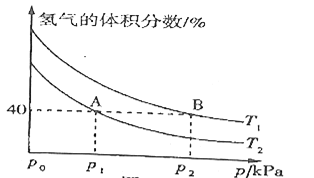
合成![]() ,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
,平衡时混合物中氢气的体积分数与温度、压强的关系如图所示:
①下列有关说法能够证明恒温恒压时,反应![]()
![]() 一定达到平衡状态的是__________(填序号)。
一定达到平衡状态的是__________(填序号)。
![]() .
.![]() 和
和![]() 的转化率相等
的转化率相等
![]() .反应体系中混合气体密度保持不变
.反应体系中混合气体密度保持不变
![]() .
.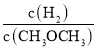 的值保持不变
的值保持不变
![]() .反应体系压强保持不变
.反应体系压强保持不变
②图中![]() ________
________![]() (填“>”“<”或“=”);理由是____________。
(填“>”“<”或“=”);理由是____________。
③在![]() 、
、![]() 两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:
两点对应的条件下,该反应从开始到平衡时生成二甲醚的平均速率:![]() _____
_____![]() 。
。
④![]() 点对应的
点对应的![]() _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
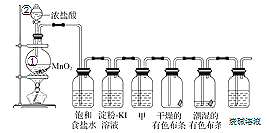
请按要求回答下列问题:
(1)仪器②的名称___________,①中反应的离子方程式__________
(2)浓盐酸的作用_______、______________,饱和食盐水的作用__________
(3)淀粉KI溶液中观察到的现象是______________,反应的离子方程式为________。
(4)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(5)Cl2与烧碱溶液反应制取84消毒液的化学方程式为________。
(6)该兴趣小组用0.2mol 二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物,说法不正确的是
A.氮气是空气中含量最高的气体,性质比较稳定
B.人工固氮需要在高温高压催化剂的条件下进行,但这是个放热反应
C.工业硝酸往往会发黄,因为其中含有Fe3+
D.常温下,浓硝酸可以利用铁罐车进行运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是一种皮肤药物的中间体,结构如图所示,下列说法不正确的是:
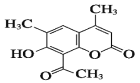
A.该有机物所有碳原子都可能同平面
B.该有机物遇FeCl3会显紫色
C.1mol该有机物最多可以与2molNaOH反应
D.1mol该有机物最多可以与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个相同带活塞的容器,向容器a中充入NO2(g)待颜色不再变化,再向容器b中充入溴蒸汽,使两容器的颜色和体积相等〔注意:同浓度的NO2和Br2蒸汽颜色相同,2NO2(g)![]() N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
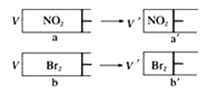
A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.若对a和b以极慢的速度缓缓压缩,则a和b的颜色均慢慢加深,但在每一个相同的时间点,b的颜色总比a的深
C.假设容器和活塞均为无色,从容器左侧观察a和a′,a′的颜色比a浅
D.气体的物质的量:na一定大于nb′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用18mol/L 的浓硫酸配制80mL3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④检漏、转移、洗涤 ⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是___mL,量取浓硫酸所用的量筒的规格是___(用下列编号填空)。
A.10 mL B.25mL C.50mL D.100mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm处,改用___向容量瓶中滴加蒸馏水至凹液面和刻度线相切为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(3)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”“偏小”或“无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水___;
②在转入容量瓶前烧杯中溶液未冷却至室温___;
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
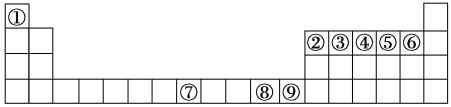
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的______________区。
(2)②、⑥两元素形成的化合物的空间构型为______________,其中心原子的杂化轨道类型为________。
(3)写出元素③与元素⑤形成的稳定化合物的结构式_______________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:______。
(5)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
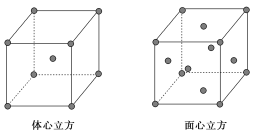
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com