
����Ŀ����ͼ��Ԫ�����ڱ��е�ǰ�����ڣ��١���Ϊ��Ӧ��Ԫ�أ������ѡ����ʵ�Ԫ�ػش����⣺
��1������Ԫ��ԭ�ӵ���Χ�����Ų�������Ԫ�����ڱ��ɻ���Ϊ�������Ԫ��λ�����ڱ���______________����
��2���ڡ�����Ԫ���γɵĻ�����Ŀռ乹��Ϊ______________��������ԭ�ӵ��ӻ��������Ϊ________��
��3��д��Ԫ�آ���Ԫ�آ��γɵ��ȶ�������Ľṹʽ_______________��
��4����Ķ���������������Ģܵ��⻯���ˮ�������õ����ӷ���ʽΪ��______��
��5��Ԫ�آ���CO���γ�X(CO)5�ͻ�����û����ﳣ���³�Һ̬���۵�Ϊ��20.5 �棬�е�Ϊ103 �棬�����ڷǼ����ܼ����ݴ˿��жϸû����ᄃ������________���壨������ͣ���
��6��Ԫ�آ�����ӵ��������ﲻ����ˮ���������ڰ�ˮ�У���������NH3���ϵ�������Ϊ________��
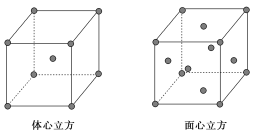
��7�������ߵľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ��������������������������������ʵ�ʺ��е�ԭ�Ӹ���֮��Ϊ________��
���𰸡�s ƽ���������� sp2�ӻ� O��C��O Cu2����4NH3��H2O=[Cu(NH3)4]2����4H2O ���� ��λ�� 2��1
��������
����Ԫ�����ڱ��е�λ�ã������ƶϢ�ΪH����ΪB����ΪC����ΪN����ΪO����ΪF����ΪFe����Cu����Zn��
��1����HԪ��λ��I A�壬����s����
��2���ڢ��γɵĻ�����ΪBF3����ռ乹��Ϊƽ���������Σ�����ԭ��B�Ĺ���ӻ�����Ϊsp2�ӻ���
��3���ۢ��γɵ��ȶ�������ΪCO2����ṹʽΪO��C��O��
��4����Ķ���������ΪCu2+���ܵ��⻯���ˮ����ΪNH3��H2O �����߷�Ӧ�����ӷ���ʽΪ��Cu2����4NH3��H2O=[Cu(NH3)4]2����4H2O��
��5���û����ﳣ���³�Һ̬���۵�Ϊ��20.5 �棬�е�Ϊ103 �棬�����ڷǼ����ܼ�����û����ᄃ�����ڷ��Ӿ��壻
��6���������ΪZn2+�����ڰ�ˮ�γ�[Zn(NH3)4]2�����ӣ�Zn2+��NH3���ϵ�������Ϊ��λ����
��7������������������ԭ�Ӹ���Ϊ��![]() =4������������������ԭ�Ӹ���Ϊ��
=4������������������ԭ�Ӹ���Ϊ��![]() =2�������ֶѻ���ʽ������ԭ�Ӹ�����Ϊ2��1��
=2�������ֶѻ���ʽ������ԭ�Ӹ�����Ϊ2��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S���ֽ������ͨ��CO2��CH4�ᷢ�����·�Ӧ������˵������ȷ����
A.CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)ѹ�����������ƽ��ת���ʽ�����
2H2(g)+2CO(g)ѹ�����������ƽ��ת���ʽ�����
B.H2S(g)+CO2(g)![]() H2O(g)+COS(g)ͨ��CO2�����ٽ���Ӧ�Ľ���
H2O(g)+COS(g)ͨ��CO2�����ٽ���Ӧ�Ľ���
C.��֪2H2S(g)+CH4(g)![]() 4H2(g)+CS2(g) ��H��0����÷�Ӧ�ڸ��������Է�
4H2(g)+CS2(g) ��H��0����÷�Ӧ�ڸ��������Է�
D.2H2S(g)![]() 2H2(g)+S(g) ��H��0
2H2(g)+S(g) ��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ˮú�����״����Ҵ��ȶ�����Ҫ�Ļ���ԭ�ϡ�
��1��ˮú������ԭ���ǣ�C(s)+H2O(g) ![]() CO(g)+ H2(g) ��H = +131.3kJ��mol-1��
CO(g)+ H2(g) ��H = +131.3kJ��mol-1��
����˵���÷�Ӧ�ﵽƽ��״̬����______������ĸ����
A��v��(CO)= v��(H2) B��c(CO)=c(H2)
C�����������У������ܶȲ��� D�����������У�����ѹǿ����
�ڸ÷�Ӧ�ﵽ��ѧƽ��ʱ����Ҫ����ˮ������ת���ʿɲ�ȡ�Ĵ�ʩ��____������ĸ����
A������̼�����ʵ��� B������ˮ���������ʵ���
C������ѹǿ D�������¶�
��2����֪��CO(g)+ 2H2 (g)![]() CH3OH(g)�������ʵ����� CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��������������ݻ�ѹ��Ϊԭ����һ�루�����������䣩����ƽ����ϵ������Ӱ����______������ĸ����
CH3OH(g)�������ʵ����� CO��H2�ڴ��������·�Ӧ���ɼ״���ƽ��������������ݻ�ѹ��Ϊԭ����һ�루�����������䣩����ƽ����ϵ������Ӱ����______������ĸ����
A��c( H2 )���� B��CH3OH �����ʵ������� C������ƽ��ʱ![]() ��С
��С
��3����֪6H2(g)��2CO2(g) ![]() CH3CH2OH(g)��3H2O(g) �����¶�ΪT�棬�ݻ�������ܱ������У���3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������Ϊa��
CH3CH2OH(g)��3H2O(g) �����¶�ΪT�棬�ݻ�������ܱ������У���3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������Ϊa��
�ٴﵽƽ��ʱ��ת������(H2)����(CO2) = ______��
�ں����£�����������г���2mol He����H2��ת����______������������ ������С�� ��������������
����T�棬�ݻ��ɱ���ܱ������н�3mol H2��1mol CO2��ϣ��ﵽƽ��ʱCO2������������_______a���������� �������� ����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰ�г������Ʒ���������������ȷ����![]() ����
����![]()
A. ![]() Ϊֱ���η��ӣ�
Ϊֱ���η��ӣ�![]() ҲΪֱ���η���
ҲΪֱ���η���
B. ��̬![]() �Ƿ��Ӿ��壬��̬
�Ƿ��Ӿ��壬��̬![]() Ҳ�Ƿ��Ӿ���
Ҳ�Ƿ��Ӿ���
C. ![]() ��Nԭ����
��Nԭ����![]() �ӻ���
�ӻ���![]() ��Bԭ��Ҳ��
��Bԭ��Ҳ��![]() �ӻ�
�ӻ�
D. ![]() ������NaOH��Һ��
������NaOH��Һ��![]() Ҳ������NaOH��Һ
Ҳ������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.��Ҫ��ȫ������ͬ�����NaCl��MgCl2��AlCl3��Һ�е�Cl����������ͬŨ�ȵ�AgNO3�������Ϊ1:1:1����ԭNaCl��MgCl2��AlCl3��Һ�����ʵ���Ũ��֮��Ϊ
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4 ���£�������A gĦ������ΪM g��mol��1�Ŀ�������RCln �ܽ���V mLˮ�У�ǡ���γɸ��¶��µı�����Һ���ܶ�Ϊ�� g��cm��3�����й�ϵʽ�������
A. ���ʵ����������أ�A/(A��V)��100%
B. ���ʵ����ʵ���Ũ��c��1 000�� A/(MA��MV) mol��L��1
C. ���¶��´��ε��ܽ��S��100A/V g
D. 1 mL����Һ��n(Cl��)��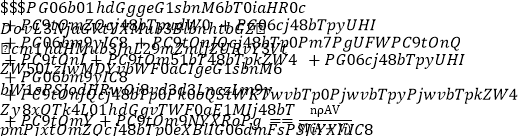 mol
mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С����Ҫ1 molL��1��CuSO4 ��Һ80 mL�����õ�����CuSO4��5H2O�������ƣ���ش��������⣺
��1�����ȡ���� ______g��
��2�����ƹ����У�����Ҫ������������ţ�________��
A��ҩ�� B���ƾ��� C��������ƽ D���ձ� E�������� F��������
�������ʵ�黹ȱ�ٵ�������________��
��3�������ƹ����У����в���������������ҺŨ��ƫ�͵���_____������ţ���
��ת��ǰ������ƿ�к�����������ˮ ��ת��ʱ������Һ�彦��
�۶���ʱ�����ӿ̶��� �� �ܵߵ�ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������в������������ý�����ȷ����
ѡ�� | ʵ����������� | ʵ����� |
A | �� NaCl��NaI �Ļ��ϡ��Һ�е�������ϡ AgNO3 ��Һ�����л�ɫ�������� | Ksp(AgCl)>Ksp(AgI) |
B | �������ữ�� H2O2 ��Һ���� Fe(NO3)2 ��Һ�У���Һ��� | ֤�������ԣ�H2O2>Fe3+ |
C | �����£��� pH �Ʋⶨ 0.1 mol��L-1 NaA ��Һ�� pH С�� 0.1 mol��L-1Na2CO3 ��Һ�� pH | ��֤�����ԣ�HA>H2CO3 |
D | ȡ a g ��������������������Һ��ַ�Ӧ���ݳ�������ͨ��Ũ����������Ϊ V L(��״����) | �ⶨ������ Al2O3 ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�������������ԭ��Ӧ�����������ӷ�Ӧ���ǣ� ��
A. �����������ķ�Ӧ B. ��Ƭ��ϡ����ķ�Ӧ
C. ���ȵ�̼�������̼��Ӧ����һ����̼ D. ����������Һ��ϡ����ķ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com