
【题目】根据下列操作和现象,所得结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向 NaCl、NaI 的混合稀溶液中滴入少量稀 AgNO3 溶液,先有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
B | 将硫酸酸化的 H2O2 溶液滴入 Fe(NO3)2 溶液中,溶液变黄 | 证明氧化性:H2O2>Fe3+ |
C | 常温下,用 pH 计测定 0.1 mol·L-1 NaA 溶液的 pH 小于 0.1 mol·L-1Na2CO3 溶液的 pH | 能证明酸性:HA>H2CO3 |
D | 取 a g 铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为 V L(标准状况下) | 测定铝箔中 Al2O3 含量 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,先有黄色沉淀生成,由于不能确定起始时氯离子和碘离子的浓度大小关系,因此不能据此得出Ksp(AgCl)>Ksp(AgI),A项错误;
B. 将硫酸酸化的过氧化氢溶液滴入Fe(NO3)2溶液中,因为硝酸根离子在酸性条件下有强氧化性、可以把亚铁离子氧化,所以,此实验无法证明H2O2氧化性强于Fe3+,B项错误;
C. 因为Na2CO3溶液的水解是分步进行的,以第一步为主,即CO32-+H2O![]() HCO3-+OH-,NaA的水解的离子方程式为A-+H2O
HCO3-+OH-,NaA的水解的离子方程式为A-+H2O![]() HA+OH-,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH,只能证明HA的酸性强于HCO3-,不能证明酸性:HA>H2CO3,C项错误;
HA+OH-,用pH计测定0.1moI/L NaA溶液的pH小于0.1moI/L Na2CO3溶液的pH,只能证明HA的酸性强于HCO3-,不能证明酸性:HA>H2CO3,C项错误;
D. 铝和氢氧化钠发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据氢气的体积可确定铝的量,可用测定含量,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)一个X原子的质量_________g。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
(5)该气体溶于1L水中(不考虑反应),所得溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(6)相同状况下,若X2与氮气以体积比1:4混合,该混合气体相对氢气密度为14.4,X2的相对分子质量为_______。
(7)若标况下X2的密度为1.25 g/L,X原子最外层有_____个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
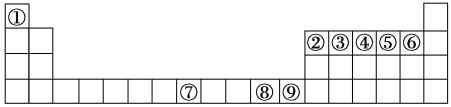
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的______________区。
(2)②、⑥两元素形成的化合物的空间构型为______________,其中心原子的杂化轨道类型为________。
(3)写出元素③与元素⑤形成的稳定化合物的结构式_______________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:______。
(5)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
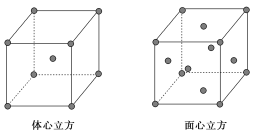
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是( )
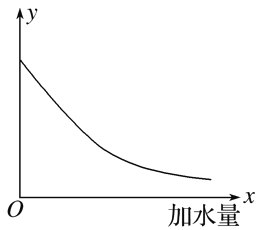
A. 溶液中H+的物质的量
B. 溶液中的c(CH3COO-)/c(CH3COOH)
C. 溶液的导电能力
D. CH3COOH的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中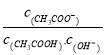 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
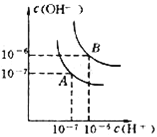
(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=____kJ/mol。
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2 和 lmol O2 发生上述反应,2min时达平衡,此时 CaSO4 为1.8mol。02min 内,用 SO2 表示的该反应的速率v(SO2)=____,其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时 SO2 的转化率____(填“增大”、“减小”或“不变”)。
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=____。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
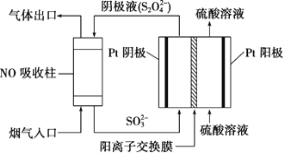
①阴极区的电极反应式为____。
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为____mL。
(5)欲用 5L Na2CO3 溶液将 23.3g BaSO4 固体全都转化为 BaCO3,则所用的 Na2CO3 溶液的物质的量浓度至少为____。[已知:常温下K(BaSO4)=1×107、K(BaCO3)=2.5×106]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列4个化学反应中,与其他3个反应类型不同的是( )
A. CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
B. CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
C. 2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
D. CH3CH2OH+HBr→CH3CH2Br+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com