
【题目】(1)SO2 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 ΔH=____kJ/mol。
(2)SO2是形成酸雨的主要污染物,燃煤脱硫原理为 2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)。向 10L 恒温恒容密闭容器中加入 3mol CaO,并通入 2mol SO2 和 lmol O2 发生上述反应,2min时达平衡,此时 CaSO4 为1.8mol。02min 内,用 SO2 表示的该反应的速率v(SO2)=____,其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时 SO2 的转化率____(填“增大”、“减小”或“不变”)。
(3)NO 的排放主要来自于汽车尾气,净化原理为:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=746.8kJ/mol。实验测得,v正=k正·c2(NO)·c2(CO),v 逆=k逆·c(N2)·c2(CO2)(k 正、k 逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在 1L 的密闭容器中充入 1molCO 和 1mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=____。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
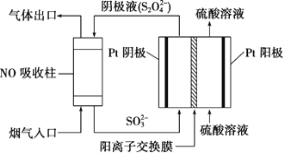
①阴极区的电极反应式为____。
②NO 吸收转化后的主要产物为 NH4+,若通电时电路中转移了 0.3mol e-,则此通电过程中理论上吸收的 NO 在标准状况下的体积为____mL。
(5)欲用 5L Na2CO3 溶液将 23.3g BaSO4 固体全都转化为 BaCO3,则所用的 Na2CO3 溶液的物质的量浓度至少为____。[已知:常温下K(BaSO4)=1×107、K(BaCO3)=2.5×106]。(忽略溶液体积的变化)
【答案】2a+2b+c 0.09mol/(L·min) 增大 ﹤ ![]() 2SO32-+4H++2e- =S2O42-+2H2O 1344 0.52mol/L
2SO32-+4H++2e- =S2O42-+2H2O 1344 0.52mol/L
【解析】
(1)根据盖斯定律解答;
(2)根据化学反应速率的数学表达式计算反应速率;向正反应方向进行,气体物质的量减小,维持恒压不变,SO2的转化率比恒容时增大;
(3)①正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数,据此解答;
②当反应达到平衡时,![]() 故
故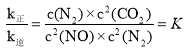 ,平衡时
,平衡时![]() ,
,![]() ,据此解答;
,据此解答;
(4)①阴极区发生还原反应,从图中找出阴极反应物,写它发生还原反应的电极反应式;
②NO吸收转化后的主要产物为NH4+,写出关系式,按电子数守恒,求出一氧化氮在标准状况下体积;
(5) n(BaSO4)=![]() =0.1mol,将0.1mol硫酸钡溶解于5L溶液中,设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO42-)=0.02mol/L,此时溶液中c(CO32-)=(x-0.02)mol/L,由BaSO4+CO32-=BaCO3+SO42-可知,此反应的化学平衡常数
=0.1mol,将0.1mol硫酸钡溶解于5L溶液中,设至少需要物质的量浓度为xmol/L的Na2CO3溶液,当BaSO4完全溶解后,所得5L溶液中c(SO42-)=0.02mol/L,此时溶液中c(CO32-)=(x-0.02)mol/L,由BaSO4+CO32-=BaCO3+SO42-可知,此反应的化学平衡常数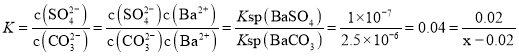 。
。
(1)根据盖斯定律,热化学方程式①×2+②×2+③得:![]() ,故该反应的
,故该反应的![]() ,故答案为:2a+2b+c;
,故答案为:2a+2b+c;
(2)生成CaSO4物质的量为1.8mol的同时消耗SO2的物质的量为1.8mol,根据化学反应速率的数学表达式,v(SO2)=1.8/(10×2)mol/(L·min)=0.09 mol/(L·min);向正反应方向进行,气体物质的量减小,维持恒压不变,SO2的转化率比恒容时增大,故答案为:0.09mol/(L·min);增大;
(3)①正反应为放热反应,升高温度平衡向左移动,则正反应速率增大的倍数小于逆反应速率增大的倍数,浓度不变,故![]() 增大的倍数小于
增大的倍数小于![]() 增大的倍数,故答案为:
增大的倍数,故答案为:![]() ;
;
②当反应达到平衡时,![]() 故
故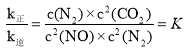 ,平衡时
,平衡时![]() ,
,![]() ,则
,则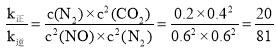 ,故答案为:
,故答案为:![]() ;
;
(4) ①由图可知,阴极区通入液体主要含SO32-,流出主要含S2O42-,所以阴极区电极反应式为2SO32-+4H++2e-=S2O42-+2H2O,故答案为:2SO32-+4H++2e-=S2O42-+2H2O;
②NO吸收转化后的主要产物为NH4+,若通电一段时间后阴极区n(SO32-)减少了0.3mol,此过程转移0.3mole;由于NO吸收转化后的主要产物为NH4+,NO~NH4+~5e,若电路中转移转移0.3mole,消耗NO0.06mol,标准状况下体积为V(NO)=0.06mol×22.4L/mol=1.344L=1344mL,故答案为:1344;
(5)设至少需要物质的量浓度为x的![]() 溶液,当
溶液,当![]() 完全溶解后,所得5L溶液中
完全溶解后,所得5L溶液中![]() ,此时溶液中
,此时溶液中![]() ,由
,由![]() 可知,此反应的化学平衡常数
可知,此反应的化学平衡常数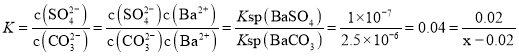 ,解得
,解得![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】煤、水煤气、甲醇、乙醇等都是重要的化工原料。
(1)水煤气生产原理是:C(s)+H2O(g) ![]() CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
①能说明该反应达到平衡状态的是______(填字母)。
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,气体密度不变 D.恒容容器中,气体压强不变
②该反应达到化学平衡时,若要增大水蒸气的转化率可采取的措施是____(填字母)。
A.增加碳的物质的量 B.增加水蒸气的物质的量
C.增大压强 D.升高温度
(2)已知:CO(g)+ 2H2 (g)![]() CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
A.c( H2 )减少 B.CH3OH 的物质的量增加 C.重新平衡时![]() 减小
减小
(3)已知6H2(g)+2CO2(g) ![]() CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
①达到平衡时,转化率α(H2):α(CO2) = ______。
②恒容下,再向该容器中充入2mol He,则H2的转化率______(填“增大” 、“减小” 或“不变”)。
③在T℃,容积可变的密闭容器中将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数_______a(填“>” 、“<” 或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组需要1 molL﹣1的CuSO4 溶液80 mL,现用胆矾(CuSO4·5H2O)来配制,请回答下列问题:
(1)需称取胆矾 ______g。
(2)配制过程中,不需要的仪器(填序号)________。
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.蒸发皿
完成配制实验还缺少的仪器是________。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有_____(填序号)。
①转移前,容量瓶中含有少量蒸馏水 ②转移时有少量液体溅出
③定容时,俯视刻度线 ④颠倒摇匀后发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列操作和现象,所得结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向 NaCl、NaI 的混合稀溶液中滴入少量稀 AgNO3 溶液,先有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
B | 将硫酸酸化的 H2O2 溶液滴入 Fe(NO3)2 溶液中,溶液变黄 | 证明氧化性:H2O2>Fe3+ |
C | 常温下,用 pH 计测定 0.1 mol·L-1 NaA 溶液的 pH 小于 0.1 mol·L-1Na2CO3 溶液的 pH | 能证明酸性:HA>H2CO3 |
D | 取 a g 铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为 V L(标准状况下) | 测定铝箔中 Al2O3 含量 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是

A. 该反应的化学方程式:2CO2+4H2![]() 2CH3OH+O2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某铁盐含三种元素,为了探究其组成并将之转化为硫酸铁,设计了如下实验:

请回答:
(1)铁盐X的化学式为________________,气体乙的化学式为________________。
(2)写出溶液A中加入H2O2后发生反应的离子方程式______________________。
(3)由溶液B制备纯净硫酸铁的一系列操作为:蒸发浓缩、______、过滤、洗涤、干燥。
(4)为确保溶液A到B反应完全,需要检验B溶液中有无Fe2+残留,请设计简单的实验:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应,又属于离子反应的是( )
A. 甲烷与氧气的反应 B. 铝片与稀盐酸的反应
C. 灼热的碳与二氧化碳反应生成一氧化碳 D. 氢氧化钠溶液与稀盐酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
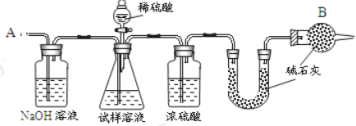
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com