
【题目】某化学实验小组需要1 molL﹣1的CuSO4 溶液80 mL,现用胆矾(CuSO4·5H2O)来配制,请回答下列问题:
(1)需称取胆矾 ______g。
(2)配制过程中,不需要的仪器(填序号)________。
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.蒸发皿
完成配制实验还缺少的仪器是________。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有_____(填序号)。
①转移前,容量瓶中含有少量蒸馏水 ②转移时有少量液体溅出
③定容时,俯视刻度线 ④颠倒摇匀后发现液面低于刻度线,再加水至刻度线
【答案】25.0 B F 100mL容量瓶、胶头滴管 ②④
【解析】
(1)根据实验室无80mL的容量瓶,只能选用100mL容量瓶配制出100mL溶液来计算;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1)实验室无80mL的容量瓶,只能选用100mL容量瓶配制出100mL溶液,故所需的胆矾的质量m=nM=CVM=1mol/L×0.1L×250g/mol=25.0g,
因此,本题正确答案是:25.0;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可以知道实验过程中需要托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管、洗瓶等仪器,则不需要BF,还缺少100mL容量瓶、胶头滴管,
因此,本题正确答案是:BF;100mL容量瓶、胶头滴管;
(3)①转移前,容量瓶中含有少量蒸馏水对浓度无影响;
②转移时有少量液体溅出,则导致溶质的损失,故所配溶液的浓度偏低
③定容时,俯视刻度线,会导致溶液体积偏小,则浓度偏高;
④因为摇匀时,容量瓶的壁上会残留部分溶液,再继续滴加蒸馏水使液面与刻度线相切,会造成溶液的浓度偏低。
因此,本题正确答案是:②④。


科目:高中化学 来源: 题型:
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
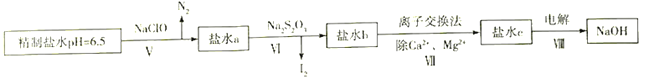
①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
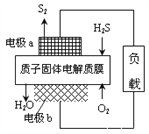
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向氨水溶液中通入CO2,各种离子的变化趋势如下图所示。下列说法正确的是
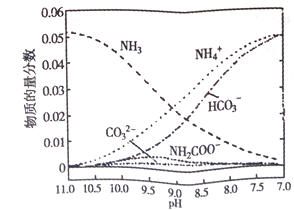
A. 随着CO2的通入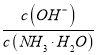 不断增大
不断增大
B. 在pH=9.0时,c(NH4+)>c(CO32-)><(HCO3-)>c(NH2CO0O-)
C. 溶液中: c(NH4+)+c(NH3)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
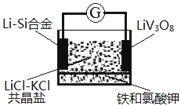
A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时LiV3O8一极反应为:Li1+xV3O8-xe═LiV3O8+xLi+
C. 外电路中有NA个电子发生转移时,有7.0gLi+移向Li-Si合金一极
D. Li-Si合金熔点高于352℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
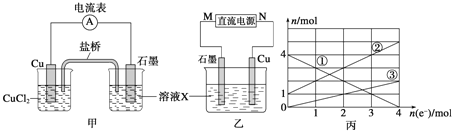
①图中X溶液是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示.该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________。

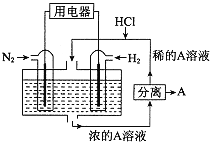
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________________________,A是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com