
【题目】已知:① Fe + H2SO4(稀) ![]() FeSO4 + H2↑
FeSO4 + H2↑
② CuO + H2 ![]() Cu + H2O
Cu + H2O
③ MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
试回答下列问题:
(1)反应①中_________作氧化剂(填化学式),___________是氧化产物(填化学式);若有2mol Fe完全反应,转移的电子数为________ mol。
(2)用双线桥法表示反应②电子转移的方向和数目:________
(3)反应③中HCl体现了_________________性和_______________性
【答案】H2SO4 FeSO4 4 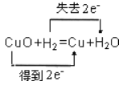 还原性 酸性
还原性 酸性
【解析】
(1)反应①中Fe元素化合价从0价升高到+2价,失去电子,H元素从+1价降到0价,得到电子,据此分析;
(2)反应②中Cu元素化合价从+2价降低到0价,得到电子,H元素化合价从0价升高到+1价,失去电子,据此画出双线桥;
(3)反应③中Cl元素部分化合价从-1价升高到0价,失去电子,另一部分化合价不变。
(1)反应①中Fe化合价升高,失去电子,作还原剂,H2SO4中H化合价降低,得到电子,作氧化剂,FeSO4 是氧化产物,H2是还原产物,1mol Fe完全反应,转移的电子为2mol,2mol Fe完全反应,转移的电子为4mol;
(2)反应②中Cu元素化合价从+2价降低到0价,得到电子,H元素化合价从0价升高到+1价,失去电子,则双线桥为 ;
;
(3)反应③中Cl元素部分化合价从-1价升高到0价,失去电子,体现了还原性,另一部分化合价不变,体现了酸性,因此盐酸体现了还原性和酸性。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
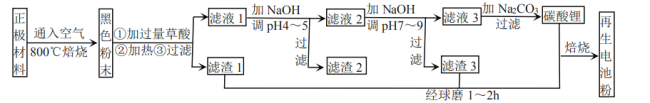
【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
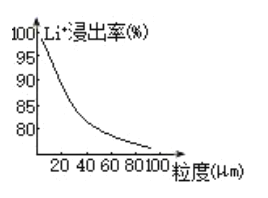
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中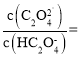 ___________。
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
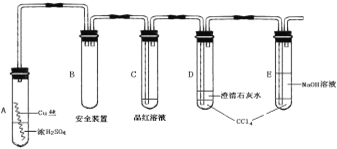
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的几片滤纸。
(2)计算。配制该溶液需称取NaCl晶体的质量为________g。
(3)称量。
①称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
②称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是________________________。
(5)转移、洗涤。在转移时应使用____________________引流,洗涤烧杯2~3次是为了________________________________。
(6)定容,摇匀。
(7)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
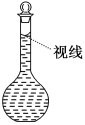
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
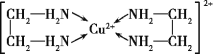
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。
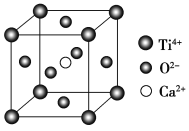
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/L NH4HCO3 溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
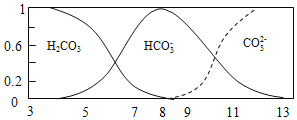
A. 常温下,Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11 时,随着pH值的增大,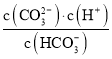 增大
增大
D. pH=3时,有c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
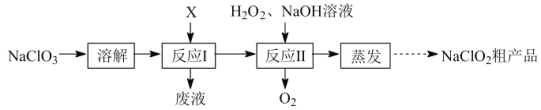
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
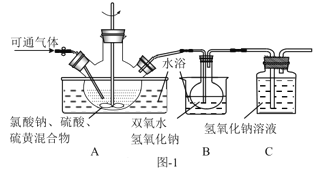
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
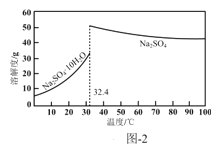
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com