
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:

(1)若某种固体物质受热发生了分解,下列说法正确的是( )
A.充分加热后一定有固体残留 B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化 D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,则Na2SO3固体加热到600℃以上分解的化学方程式 。如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为 ;
(3)如果加热温度高于600℃一段时间后,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到得现象为 。
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,以下是检验阴离子(X)的两种实验方案,你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(1)D(2分)
(2)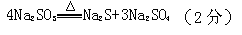 ,先逐渐增大,后逐渐减小(2分)
,先逐渐增大,后逐渐减小(2分)
(3)2S2-+SO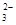 +6H+ =3S↓+3H2O(2分); B中品红溶液褪色,C中无明显变化(或答“B中无明显变化,C中产生黑色沉淀”,
答“B中品红溶液褪色,C中产生黑色沉淀”不得分) (2分)
+6H+ =3S↓+3H2O(2分); B中品红溶液褪色,C中无明显变化(或答“B中无明显变化,C中产生黑色沉淀”,
答“B中品红溶液褪色,C中产生黑色沉淀”不得分) (2分)
(4)乙(2分);甲中先加入具有强氧化性的稀HNO3,它能将SO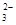 氧化成SO
氧化成SO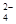 ,不能判定是否生成SO
,不能判定是否生成SO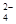 (2分)
(2分)
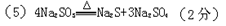 (2分)
(2分)
【解析】
试题分析:(1)A.充分加热后不一定有固体残留,如碳酸氢铵分解,故A不符合; B.加热前后固体颜色不一定无变化,如高锰酸钾溶液前后有元素变化,故B不符合;C.加热前后固体质量不一定有变化,如亚硫酸钠受热分解生成硫化钠和硫酸钠,因分解产物都是固体,因此反应前后固体质量并没有发生变化,故C不符合; D.一定生成了新的物质,化学反应一定有新物质变化,故D符合;E.充分加热后得到的残留固体不一定为混合物,如氯酸钾完全分解生成氯化钾和氧气,故E不符合;故选D; (2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,故答案为:先逐渐增大,后逐渐减小;(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;生成二氧化硫的反应为SO32-+2H+=SO2↑+H2O,此时在B、C两装置中可能观察到得现象为二氧化硫具有漂白作用使品红褪色,生成的气体不是硫化氢通过硫酸铜无现象;(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).通过实验分析判断,离子为硫酸根离子,确定分解产物为硫化钠和硫酸钠,为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可以用玻璃棒搅拌或加热,检验硫酸根离子是加入盐酸,无变化,再加入氯化钡生成白色沉淀证明是硫酸根离子;甲实验加硝酸,原来溶液中含亚硫酸钠,遇硝酸被氧化为硫酸钠,干扰硫酸根离子的检验,故答案为:搅拌(或加热); 乙;甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-;(5)依据上述分析判断,亚硫酸钠加热到600℃以上分解生成硫化钠和硫酸钠,反应的化学方程式为4Na2SO3=Na2S+3Na2SO4。
考点:本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用,题目难度中等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
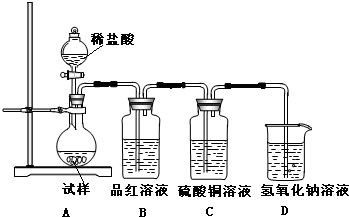 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2014届湖北省襄阳市等四校高三上学期期中联考化学试卷(解析版) 题型:实验题
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加
热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
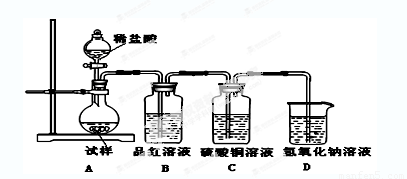
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠
和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至
足量,在滴加稀盐酸的整个过程中 的物质的量浓度变化趋势为 ;
的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除 外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
(4)写出 固体加热到600℃以上分解的化学方程式
。
固体加热到600℃以上分解的化学方程式
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省商丘市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为________________;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为__________;此时在B、C两装置中可能观察到的现象为___________或___________。
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为___________。检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取____________措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是______(填“甲”或“乙”)。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com