
【题目】在一定温度下,下列叙述表明可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是 ( )
2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④A、B、C的百分含量不在变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A. ①③④⑤⑥⑦⑧B. ②⑤⑧C. ①③④⑤⑥⑦D. ②⑤⑥⑧
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是( )
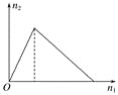
A.X为氢氧化钠,Y为氯化铝
B.X为氯化铝,Y为氢氧化钠
C.X为盐酸,Y为偏铝酸钠
D.X为偏铝酸钠,Y为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极极板,通过导线与直流电源相连。下列说法不正确的是 ( )
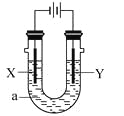
A. 若电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液
B. 若X为铁电极、Y为石墨电极,电解饱和氯化钠溶液一段时间,在两极分别滴加酚酞,X极变红色
C. 若用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子为0.2mol
D. 若X、Y为铂电极,a溶液为250mL CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹用于治疗对氯喹敏感的恶性疟、间日疟及三日疟。若干位药物研发和临床专家研究发现,该药物在细胞水平上能有效抑制新型冠状病毒的感染。
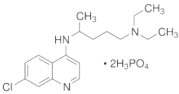
(1)磷酸氯喹是由多种元素形成的物质,其中氯元素的基态氯原子,电子占据的最高能层符号为_____;磷元素的简单氢化物PH3的中心原子杂化方式是_____,属于_______(填“极性”或“非极性”)分子;其他的四种元素的第一电离能从大到小的顺序为_________。
(2)N与P为同族元素,比较其最高价氧化物的水化物酸性并从结构的角度说明理由:________
(3)H3PO4与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+的核外电子排布式为___________;![]() 做为配体为铁离子提供______。
做为配体为铁离子提供______。
(4)磷化铜(Cu3P2)用于制造磷青铜。磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件,其晶胞结构如图所示:
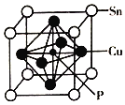
①其化学式为__________
②铜或铜盐的焰色反应为_____色,金属元素能产生焰色实验的微观原因为______。
③若晶体密度为ρg/cm3,摩尔质量为Mg/mol,NA代表阿伏加德罗常数,则最近的Cu原子核间距为________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
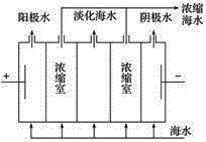
A.海水提溴的过程中,没有发生氧化还原反应
B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同
C.从海水中可以得到NaCl,电解NaCl溶液可制备金属钠
D.如图,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,此法称为电渗析法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法错误的是( )
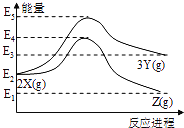
A. 由![]() 反应的ΔH >0
反应的ΔH >0
B. 由![]() 反应的ΔH = (E2-E1) kJ/mol
反应的ΔH = (E2-E1) kJ/mol
C. 降低压强有利于提高Y的产率
D. 降低温度有利于提高Z的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
A. 231.5mL B. 268.8mL C. 287.5mL D. 313.6mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
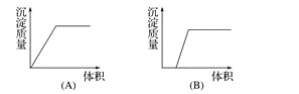
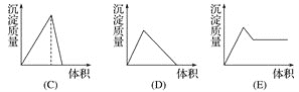
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com