
����Ŀ������ʱ���о�pH��һ��Ũ��FeSO4���ȶ��Ե�Ӱ�죬������ͼ��������������

A. pHС��1ʱ��������������ģ����ܵ�ԭ����4Fe2++ O2+ 10H2O![]() 4Fe(OH)3 + 8H+ƽ�������ƶ�
4Fe(OH)3 + 8H+ƽ�������ƶ�
B. pH��3.0~5.5֮�䣬pH�ı仯��FeSO4�ȶ���Ӱ�첻��
C. pH����6.5ʱ�����������ͻ�䣬���ܵ�ԭ�������ɵ�Fe(OH) 2���ױ�����
D. ����������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬FeSO4���ȶ��Լ���
���𰸡�D
��������A��Fe2+����O2��Ӧ����Ӧ����ʽΪ4Fe2++O2+10H2O4Fe(OH)3+8H+��pHС��1ʱ��c(H+)Ũ�Ƚϴ�Ӧ������У�Fe2+��������ģ���A��ȷ��B����ͼ��֪��pH��3.0��5.5֮�䣬Fe2+��������������䣬˵��pH��3.0��5.5֮�䣬pH�仯��FeSO4�ȶ���Ӱ�첻��B��ȷ��C��pH����6.5ʱ��c(H+)Ũ�Ƚ�С�����������ͻ�䣬����ԭ�������Լ�����2�������ױ���������C��ȷ��D������������ͬʱ��FeSO4��Һ�м�������(NH4)2SO4���壬NH4+ˮ�⣬c(H+)Ũ������4Fe2++O2+10H2O4Fe(OH)3+8H+������У�����Fe2+�ı�������FeSO4���ȶ�����ǿ����D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ������Ļ�ѧ�ң�1991����ȷ���In�����ԭ������Ϊ114.818�����������ԭ������ίԱ�����Ϊ�µı�ֵ������˵���У�������ǣ� ��
A. ![]() In��InԪ�ص�һ�ֺ��� B.
In��InԪ�ص�һ�ֺ��� B. ![]() Inԭ�Ӻ�����49������
Inԭ�Ӻ�����49������
C. ![]() Inԭ�Ӻ�����������������֮��Ϊ115 D.
Inԭ�Ӻ�����������������֮��Ϊ115 D. ![]() Inԭ�Ӻ�����49������
Inԭ�Ӻ�����49������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������ʯī������1 L Ũ��Ϊ1 mol��L��1ʳ��ˮ�С�����˵����ȷ����(����)
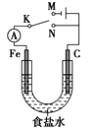
A. �����K��N���ӣ������������ḯʴ
B. �����K��N���ӣ�������Ӧʽ��4OH����4e��===2H2O��O2��
C. �����K��M���ӣ���ʯī��������Ƭ����ʵ�������϶���
D. �����K��M���ӣ�������������28 L(��״��)����ʱ��������1 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ���ڻ������в��ܴ��ڵĻ�ѧ���ǣ�������
A.���Ӽ�B.���ۼ�C.���Լ� D.�Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⷨ�������Ժ�����ˮ(��Ҫ����Cr2O![]() )ʱ�����������������������������д��ڷ�ӦCr2O
)ʱ�����������������������������д��ڷ�ӦCr2O![]() ��6Fe2����14H��===2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ������˵������ȷ����(����)
��6Fe2����14H��===2Cr3����6Fe3����7H2O�����Cr3����Cr(OH)3��ʽ��ȥ������˵������ȷ����(����)
A. ������ӦΪFe��2e��===Fe2��
B. ����������ҺpH����仯
C. ������������Fe(OH)3��������
D. ÿת��12 mol���ӣ���1 mol Cr2O![]() ����ԭ
����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӷϾ�Һ����ʾ�������� ITO����Ҫ�ɷ��Ǻ������������������������������ʾ��ͼ���¡�
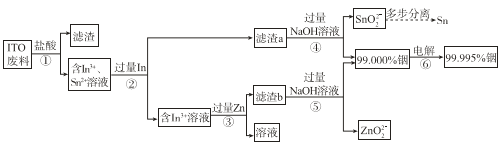
���ϣ�
���� | ����In�� | ����Sn�� |
���ڱ�λ�� | �������ڡ���IIIA�� | �������ڡ���IVA�� |
��ɫ��״̬ | ����ɫ���� | ����ɫ���� |
���������� | ������Ӧ | ������Ӧ |
��ǿ����Һ | ����Ӧ | ��Ӧ |
��1��Ϊ�˼ӿ첽��ٵķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��______�����ٴ����㣩��
��2�������������������ת����In3+�����ӷ���ʽ��______��
��3��������м���������ܹ���ȥ��Һ�е�Sn2+�������������Ϸ�����ԭ����______��
��4������ܺ͢���NaOH��Һ��������______��
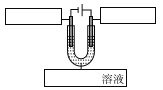
��5����ͼ��ģ�⾫������װ��ͼ�����ڷ�������д��Ӧ�����ʡ�_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ�س�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn��2K2FeO4��8H2O![]() 3Zn(OH)2��2Fe(OH)3��4KOH��������������ȷ����
3Zn(OH)2��2Fe(OH)3��4KOH��������������ȷ����
A. �ŵ�ʱ������ӦΪ��Zn��2e-��2OH-��Zn(OH)2
B. ���ʱ������ӦΪ��Fe(OH)3��3e-��5OH-��![]() ��4H2O
��4H2O
C. �ŵ�ʱÿת��3 mol���ӣ�������1 mol K2FeO4������
D. �ŵ�ʱ����������Һ�ļ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������������������м��㷺��;��
��1����֪��Ӧ����2NH3��g��+CO2��g���TNH2CO2NH4��s����H=��159.5kJ/mol
��Ӧ����NH2CO2NH4��s���TCO��NH2��2 ��s��+H2O��g����H= + 116.5kJ/mol
��Ӧ����H2O��l���TH2O��g����H= + 44.0kJ/mol
��ҵ����CO2��NH3Ϊԭ�Ϻϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽΪ___________________���÷�Ӧ��_________�����¿����Է����У��������������������������κ��¶���������
��2���������Ͽ�֪�������£�K��[Ag��NH3��2+]=1.00��107��Ksp[AgCl]=2.50��10��10��
��������Һ�д���ƽ�⣺Ag+��aq��+2NH3��aq��![]() Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
Ag��NH3��2+ ��aq�����÷�Ӧƽ�ⳣ���ı���ʽΪK��=_______________��
�ڼ���õ����淴ӦAgCl ��s��+2NH3��aq��![]() Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
Ag��NH3��2+ ��aq��+Cl����aq���Ļ�ѧƽ�ⳣ��K=_________________________����1LŨ��Ϊ1mol/L��ˮ���������ܽ�AgClΪ_______mol������2λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ��ȡ�ġ���ˮ��þ����Ҫ�������£�
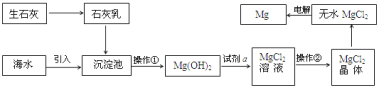
��ʾ�� ��MgCl2����Ļ�ѧʽΪMgCl26H2O��
��MgO���۵�Ϊ2852�棬��ˮMgCl2���۵�Ϊ714�档
��1�������ٵ������� ________�� �����ڵ�����___________����ȴ�ᾧ�����ˡ�
��2���Լ�a��������_____________��
��3�����Ȼ�þ�����������þ�Ļ�ѧ����ʽΪ��_____________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com