
【题目】下列说法中正确的是( )
A.含有非金属元素的化合物一定是共价化合物
B.含共价键的化合物一定是共价化合物
C.含有金属元素的化合物可以是共价化合物
D.离子化合物一定含有金属元素
科目:高中化学 来源: 题型:
【题目】光合作用得地球碳、氧循环的更要媒介。下图是利用模拟光合作用过程,将CO2和H2O转化为糖类同时释放O2的装置。下列说法正确的是
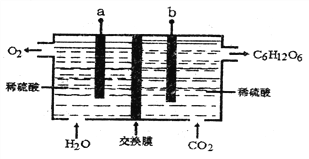
A. 该装置为原电池,其中a是原电池的正极
B. 该交换膜为阳离子交换膜,H+交换膜由左向右移动
C. 不考虑其它能量损耗,当外电路通过1mole-时生成15g葡萄糖
D. b极发生的电极反应:6CO2+24e-+18H2O=C6H12O6+24OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g) ΔH=-768.2 kJ·mol-1,
2Cu2O(s)+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116.0 kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH= ________kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作________极。
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O===4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是____________(写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为________。
(3) 氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-)的关系如图所示。
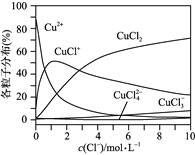
①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种的浓度大小关系为__________________________。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为___________________________,___________________________(任写两个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
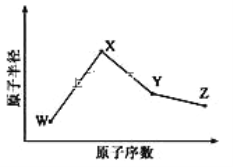
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,体积均为20 mL、浓度均为0.1 mol L-1的两种酸HX、HY分别与0.1 mol L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是
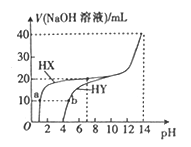
A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入4molA和2molB发生反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB
D. 3molC+1molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com