
【题目】下列物质不能用单质直接化合而制得的是( )
A.Na2O2B.FeCl3C.NO2D.SO2
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,下列说法不正确的是( )
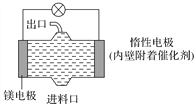
A. 惰性电极上发生氧化反应
B. 镁电极是该电池的负极
C. 正极反应式为ClO-+H2O+2e-===Cl-+2OH-
D. 进料口加入NaClO溶液,出口流出的为NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有非金属元素的化合物一定是共价化合物
B.含共价键的化合物一定是共价化合物
C.含有金属元素的化合物可以是共价化合物
D.离子化合物一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深人的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.1kJ/mol;
CH3OH(g) △H1=-90.1kJ/mol;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器___________。(填序号,下同);平衡常数最小的是容器_____________。
(3)CO常用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中![]() 与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____(填字母)。

a.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
d.CO还原PbO2的反应△H>0
(4)工业废水中含有甲醛,该厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____,总反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中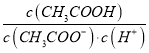 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
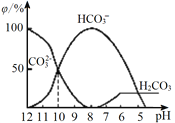
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用H2还原铁的氧化物并确定其组成的装置如图所示(Zn粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气)。
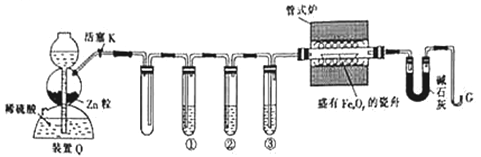
回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于_____(填字母,下同)。
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为__________________。
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为_____________。
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是__________,在这两步之间还应进行的操作是_______________。
(4)反应过程中G管逸出的气体是___________,其处理方法是___________。
(5)结束反应时,应该___________,待装置冷却后称量并记录相应数据。
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________ L,V(H2)=________ L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
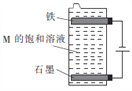
【题目】从下表的阴、阳离子中选出适当的离子组成三种电解质(每种离子只能选用一次),用惰性电极对每种电解质溶液进行电解。回答下列问题:
阳离子 | H+、Na+、Ag+ |
阴离子 | Cl-、SO42-、NO3- |
(1)若阴极放出氢气,阳极放出氧气,且电解后溶液的pH变小,则所选用的电解质的化学式是___________,阴极的电极反应式为___________。
(2)若阴极析出金属,阳极放出氧气,则所选用的电解质的化学式是___________,阳极的电极反应式为_______________________________________________________________。
(3)用如图所示装置电解第三种电解质M的饱和溶液,写出该电解池中发生反应的总化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
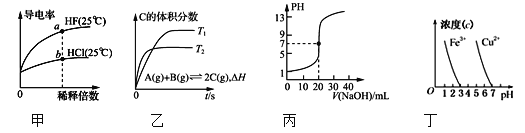
A. 由图甲可知,a点Kw的数值比b点Kw的数值大
B. 乙表示在相同的密闭容器中,不同温度下的反应,该反应的ΔH>0
C. 丙表示0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1醋酸溶液的滴定曲线
D. 根据图丁,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com