
【题目】利用H2还原铁的氧化物并确定其组成的装置如图所示(Zn粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气)。
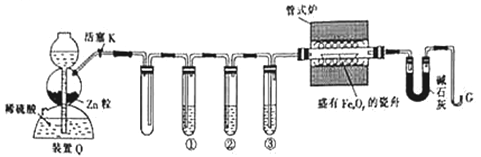
回答下列问题:
(1)装置Q(启普发生器)用于制备H2,还可用于_____(填字母,下同)。
A.生石灰与浓氨水制NH3 B.过氧化钠与水制O2
C.硫化铁固体与稀硝酸制H2S D.大理石与稀盐酸制CO2
(2)①②③中依次盛装的试剂为__________________。
A.KMnO4酸性溶液、浓H2SO4、焦性没食子酸溶液
B.焦性没食子酸溶液、浓H2SO4、KMnO4酸性溶液
C. KMnO4酸性溶液、焦性没食子酸溶液、浓H2SO4
KMnO4酸性溶液中发生反应的离子方程式为_____________。
(3)“加热管式炉”和“打开活塞K”这两步操作应该先进行的是__________,在这两步之间还应进行的操作是_______________。
(4)反应过程中G管逸出的气体是___________,其处理方法是___________。
(5)结束反应时,应该___________,待装置冷却后称量并记录相应数据。
(6)假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据: ①瓷舟的质量为30.4g;②瓷舟和FexOy的总质量为42.0g;③反应前U形管及内盛物的总质量为98.4g;④反应后U形管及内盛物的总质量为102.0g。由以上数据计算并确定该铁的氧化物的化学式为____________。
【答案】 D C 8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O 打开活塞K 检验H2 的纯度 氢气(或H2) 在G管口处放置一个点燃的酒精灯 先停止加热,冷却至室温后,再关闭活塞K Fe3O4
【解析】H2还原铁的氧化物,装置Q用于制备氢气,因盐酸易挥发,则①、②、③应分别用于除去HCl、H2S、氧气和水,得到干燥的氢气与铁的氧化物在加热条件下反应生成铁,实验结束后应先停止加热再停止通入氢气,以避免铁被重新氧化。
(1)装置Q(启普发生器)用于制备H2。A.生石灰与浓氨水制NH3时生成的氢氧化钙微溶于水,会堵塞启普发生器,错误;B.过氧化钠能够与水剧烈反应,放出大量的热,不能用启普发生器作为反应装置,错误;C.稀硝酸具有强氧化性,硫化铁固体与稀硝酸不能反应制得H2S,应该选用稀硫酸,错误;D.大理石的主要成分为碳酸钙,不溶于水,与稀盐酸制CO2可以选用启普发生器作为反应装置,正确;故选D;
(2)装置Q用于制备氢气,因盐酸易挥发,则①、②、③应分别用于除去HCl、H2S、氧气和水,得到干燥的氢气与铁的氧化物在加热条件下反应生成铁,应最后通过浓硫酸干燥,①②③中依次盛装的试剂为KMnO4酸性溶液、焦性没食子酸溶液、浓HSO4;KMnO4酸性溶液用于吸收H2S,反应的离子方程式为8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O,故答案为:C;8MnO4-+5H2S+14H+=8Mn2++5SO42-+12H2O;
(3)需要通过生成的氢气排尽装置中的空气,“加热管式炉”和“打开活塞K”这两步操作应该先进行的是打开活塞K,氢气中如果混有空气,加热时会发生爆炸,因此在这两步之间还应检验H2的纯度,故答案为:打开活塞K;检验H2的纯度;
(4)反应过程中G管逸出的气体是未反应的氢气,氢气极易燃烧,不能直接排空,可以在G管口处放置一个点燃的酒精灯,故答案为:氢气(或H2);在G管口处放置一个点燃的酒精灯;
(5)实验结束后应先停止加热再停止通入氢气,以避免铁被重新氧化,故答案为:先停止加热,冷却至室温后,再关闭活塞K;
(6)U形管内的碱石灰是原来吸收生成的水蒸气,因此生成的水的质量为102.0g-98.4g=3.6g,物质的量为0.2mol,FexOy的质量=42.0g-30.4g=11.6g,其中含有O元素的物质的量为0.2mol,质量为0.2mol×16g/mol=3.2g,则铁元素的质量为11.6g-3.2g=8.4g,物质的量为![]() =0.15mol,因此
=0.15mol,因此![]() =
=![]() =
=![]() ,则该铁的氧化物的化学式为Fe3O4,故答案为:Fe3O4。
,则该铁的氧化物的化学式为Fe3O4,故答案为:Fe3O4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
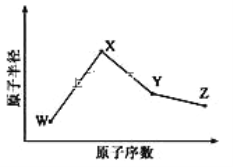
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石灰石和稀盐酸制取CO2的反应中,能影响该反应速率的条件是( )
A. 盐酸的体积 B. 盐酸的浓度
C. 石灰石颗粒的大小 D. 溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种第二代抗组胺药物的中间体G的合成路线如下:
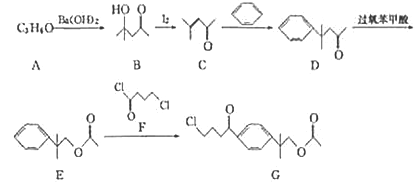
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________,由A生成B的反应类型为_______。
(2)G中含氧官能团名称为_______。
(3)F的分子式为_______。
(4)由C生成D的化学方程式为______________。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪组试剂的洗气瓶
A.澄清石灰水,浓H2SO4B.溴水,NaOH溶液,浓H2SO4
C.酸性高锰酸钾溶液,浓H2SO4D.浓H2SO4,酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL0.1mol·L-1MOH溶液中逐滴加入0.2mol·L-1HA溶液,中和滴定曲线如图所示(体积变化忽略不计)。回答下列问题:
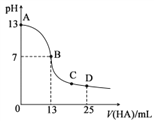
(1)写出MOH在水溶液中的电离方程式:___________。
(2)HA的电离平衡常数为___________ mol·L-l(写出计算结果)。
(3)D点时,溶液中c(A-)+c(HA)___________ 2c(M+)(填“>”“<”或“=”);溶液中离子浓度大小顺序为__________;若此时测得混合溶液的pH=a,则c(HA)+c(H+)=___________mol·L-l(用含字母a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性
B.碱性
C.氧化性
D.还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com