
【题目】化合物W是一种药物的中间体,一种合成路线如图:

已知:①![]() +
+![]()
![]()
![]()
②![]()
![]()
![]() +
+![]()
③![]()
![]()
![]()
请回答下列问题:
(1)A的系统命名为__。
(2)反应②的反应类型是__。
(3)反应⑥所需试剂和条件为__。
(4)写出反应③的化学方程式为__。
(5)写出F的结构简式:__。
(6)化合物M是D的同分异构体,则符合下列条件的M共有__种(不含立体异构)。
①1molM与足量的NaHCO3溶液反应,生成二氧化碳气体22.4L(标准状态下);
②0.5molM与足量银氨溶液反应,生成108gAg固体
其中核磁共振氢谱为4组峰且峰面积比为6∶2∶1∶1的结构简式为__(写出其中一种)。
(7)参照上述合成路线,以C2H5OH和![]() 为起始原料,选用必要的无机试剂合成
为起始原料,选用必要的无机试剂合成![]() ,写出合成路线__。
,写出合成路线__。
【答案】2,3-二甲基-1,3-丁二烯 氧化反应 浓氢溴酸、加热 ![]() +
+![]()
![]()
![]() +CH3COOH (CH2OH)3CCHO 12
+CH3COOH (CH2OH)3CCHO 12 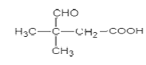 或
或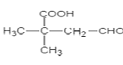 CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2Br-CH2Br
CH2Br-CH2Br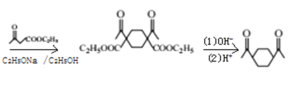
【解析】
根据合成路线,结合信息②和C的结构简式可知,B的结构简式为![]() ,根据信息①可逆推得A为
,根据信息①可逆推得A为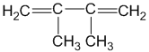 ,A发生加成反应生成 B,B被氧化得C,C发生酯化反应生成D,E发生醛基的α氢加成反应生成F,F再与氢气加成得G,G与溴化氢取代得H,
,A发生加成反应生成 B,B被氧化得C,C发生酯化反应生成D,E发生醛基的α氢加成反应生成F,F再与氢气加成得G,G与溴化氢取代得H,
(7)C2H5OH先发生消去反应生成乙烯,乙烯与溴加成得CH2BrCH2Br,用CH2BrCH2Br和![]() 发生类似题中反应⑦和反应⑧可得
发生类似题中反应⑦和反应⑧可得![]() 。
。
(1)根据上面的分析可知,A为![]() ,A的系统命名为 2,3-二甲基-1,3-丁二烯,故答案为:2,3-二甲基-1,3-丁二烯;
,A的系统命名为 2,3-二甲基-1,3-丁二烯,故答案为:2,3-二甲基-1,3-丁二烯;
(2)反应②为B被氧化得C,所以反应类型是氧化反应,故答案为:氧化反应;
(3)反应 ⑥为G与溴化氢加热条件下取代得H,所需试剂为浓氢溴酸,故答案为:浓氢溴酸、加热;
(4)反应③C生成D,反应的化学方程式为![]() +
+![]()
![]()
![]() +CH3COOH ,故答案为:
+CH3COOH ,故答案为:![]() +
+![]()
![]()
![]() +CH3COOH ;
+CH3COOH ;
(5)由已知条件③,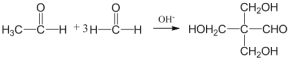 ,F的结构简式:
,F的结构简式: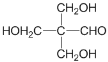 ,故答案为:
,故答案为: ;
;
(6)化合物M是D的同分异构体,根据条件①1molM与足量的NaHCO3溶液反应,生成二氧化碳气体22.4L(标准状态下),说明M中含有1个羧基;②0.5molM与足量银氨溶液反应,生成108gAg固体,说明M中含有一个醛基,则符合条件的M的结构简式为OHCCH2CH2CH2CH2COOH、OHCCH2CH2CH(CH3)COOH、OHCCH2CH(CH3)CH2COOH、OHCCH(CH3)CH2CH2COOH、OHCCH(CH3)CH(CH3)COOH、OHCCH2CH(CH2CH3)COOH、OHCCH(CH2CH3)CH2COOH、OHCC(CH2CH3)(CH3)COOH、OHCCH(CH2CH2CH3)COOH、OHCCH[-CH(CH3)2]COOH、OHCC(CH3)2CH2COOH、OHCCH2C(CH3)2COOH,共有12种,其中核磁共振氢谱为4组峰且峰面积比为6:2:1:1,即有四种位置的氢,个数比为6:2:1:1,可以推测出M中应有2个甲基,结构为 或
或 ,故答案为12;
,故答案为12; 或
或 ;
;
(7)C2H5OH先发生消去反应生成乙烯,乙烯与溴加成得CH2BrCH2Br,用CH2BrCH2Br 和![]() 发生类似题中反应⑦和反应⑧可得
发生类似题中反应⑦和反应⑧可得![]() ,合成路线为:CH3CH2OH
,合成路线为:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2Br-CH2Br
CH2Br-CH2Br 。
。


科目:高中化学 来源: 题型:
【题目】已知某离子晶体的晶胞示意图如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,晶体的密度为dg/cm3下列说法中正确的是
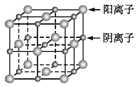
A.晶体晶胞中阴、阳离子的个数都为1
B.晶体中阴、阳离子的配位数都是4
C.该晶胞可能是NaCl的晶胞
D.该晶体中两个距离最近的阳离子的核间距为4M/(NAd)cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+![]() O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1kJ·mol-1
Hg(l)+![]() O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是( )
A.-441.8kJ·mol-1B.-254.6kJ·mol-1
C.-438.9kJ·mol-1D.-260.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
A.x+y<z
B.平衡向正反应方向移动
C.A的转化率降低
D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有__________(填代号)。
(2)经计算,需浓H2SO4的体积为____________。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是__________(填代号)。
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到__________ mL的容量瓶中,转移时应用玻璃棒__________。转移完毕,用少量蒸馏水洗涤__________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度__________处。改用__________加蒸馏水到瓶颈刻度的地方,使溶液的__________。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是_______,能引起误差偏高的有______(填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com