
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_____。写出“丙![]() 甲”转化的化学方程式:_______________________________。
甲”转化的化学方程式:_______________________________。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:___________。写出“甲![]() 乙”转化的离子方程式:________________________________。
乙”转化的离子方程式:________________________________。
【答案】Al2O32Al(OH)3![]() Al2O3+3H2OFe2O3Fe2O3+6H+=2Fe3++3H2O
Al2O3+3H2OFe2O3Fe2O3+6H+=2Fe3++3H2O
【解析】
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,应是两性化合物,则乙为硫酸铝,丙为Al(OH)3,则甲为Al2O3;
(2)若乙溶液中加入KSCN溶液,有血红色出现,应含有Fe3+,则丙为Fe(OH)3,甲为Fe2O3.
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,应是两性化合物,则乙为硫酸铝,丙为Al(OH)3,则甲为Al2O3,“丙![]() 甲”转化的化学方程式:2Al(OH)3
甲”转化的化学方程式:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(2)若乙溶液中加入KSCN溶液,有血红色出现,应含有Fe3+,则丙为Fe(OH)3,甲为Fe2O3,甲转化为乙的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;


科目:高中化学 来源: 题型:
【题目】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤③的离子方程式:_________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:___________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_______________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:
______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:① H2 ② 铝 ③ CuO ④ CO2 ⑤ NaHSO4 ⑥ Ba(OH)2固体 ⑦ 氨水 ⑧ 稀硝酸 ⑨ 熔融Al2(SO4)3。
(1)上述状态下可导电的是____________;属于电解质的是____________;属于非电解质的是______________。(填序号)
(2)写出⑤、⑨在水中的电离方程式 、 。
(3)34.2 g ⑨溶于水配成250 mL溶液,SO![]() 的物质的量浓度为___________。
的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。

(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只含SiO2杂质的石灰石样品,在高温下熔烧得到的残留物经检验为一纯净物,则原样品中SiO2的质量分数为( )
A. 28.5% B. 37.5% C. 40% D. 62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池填料(主要成分为PbO2、PbO、PbSO4等)作阴极,采取固相直接电解法可提取金属Pb,其装置如图所示(已知:PbSO4+3OH-=HPbO2-+S042-+H2O)。下列说法中错误的是

A. b与外接电源的负极相连
B. PbO2放电时电极反应式为:PbO2+4e-+2H2O=Pb+40H-
C. 电解过程中左室水的电离程度减弱(忽略溶液温度变化)
D. 与传统无膜电解法相比,该电解方法可提高铅元素利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素是组成遗传物质核酸的基本成分之一,而锡元素(Sn)形成的某些化合物能够促进核酸的合成。回答下列问题。
(1)基态磷原子电子占据的最高能层符号是____,占据该能层的电子中能量最高的电子其电子云在空间有_____个伸展方向,原子轨道呈_____形。
(2)锡元素可形成白锡、灰锡、脆锡三种单质。研究灰锡晶体的结构最常用的仪器是_____。灰锡晶体与金刚石结构相同,但灰锡不稳定,其原因是_____。
(3)固态PCl5结构中存在PCl4+和PCl6-两种结构单元,其晶胞如图所示。
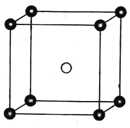
①PCl4+的空间结构为________,PCl3的键角小于PCl4+键角的原因为___________。
②已知晶胞的边长为anm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案,请完成有关问题。
方案Ⅰ:将形状和大小均相同的铁片和铜片,分别同时放入100 mL 2.0 mol·L-1稀硫酸中,观察反应的情况,据此确定它们的金属活动性。
方案Ⅱ:利用Fe、Cu作电极设计成原电池,以确定它们的金属活动性。
(1)方案Ⅰ中发生反应的离子方程式为 。
(2)在方框内画出方案Ⅱ中的原电池装置图,注明电解质溶液名称和正、负极材料,标出电子流动方向,并写出电极反应式:
正极: ;
负极: 。
(3)结合你所学的知识,请你再设计一个与方案Ⅰ、Ⅱ不同的验证Fe、Cu活动性的简单实验方案: ,用离子方程式表示其反应原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() 2C(g),反应过程混合物中C%与温度关系如下图,下列说法正确的是
2C(g),反应过程混合物中C%与温度关系如下图,下列说法正确的是
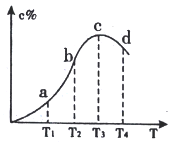
A. 正反应速率: v(c)>v(d)>v(b) B. 化学平衡常数: K(d)>K(c)
C. 由c向d变化时,v(正)<v(逆) D. 该可逆反应的正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com