

分析 (1)酸或碱、强酸酸式盐抑制水电离,含有弱离子的盐促进水电离,常温下水电离出的c(H+)=c(OH-)=10-7mol/L,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,水的电离被抑制,说明溶液中的溶质为酸、碱或强酸酸式盐,酸溶液中氢氧根离子完全由水电离,碱溶液中氢离子完全由水电离,根据各选项PH进行分析解答;
(2)根据水的离子积,先判断出酸和碱混合后溶液NaOH过量,溶液显碱性,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$求出氢氧根的浓度,然后根据水的离子积求出c(H+),即可求出溶液的pH;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
(6)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH.
解答 解:(1)A.pH等于4的醋酸溶液中,c(H+)=10-4mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=1.0×10-10mol/L,故A正确;
B.pH=10的NaOH溶液中,c(H+)=10-10mol/L,对水的电离起到抑制作用,碱溶液中氢离子完全由水电离,水电离出的c (OH-)=c(H+)=1.0×10-10mol/L,故B正确;
C.Na2CO3属于强碱弱酸盐,促进水电离,pH=9的Na2CO3溶液中,c(H+)=10-9mol/L,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,故C错误;
D.pH=2的硫酸溶液中,c(H+)=10-2mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=1.0×10-12mol/L,故D错误;
E.NH4Cl属于强酸弱碱盐,促进水电离,pH=4的NH4Cl溶液中,c(H+)=10-4mol/L,水电离出的c (OH-)=c(H+)=10-4mol/L,故E错误;
故答案为:AB;
(2)该温度下,将100mL 0.1mol•L-1的稀H2SO4中n(H+)=CV=0.2mol/L×0.1L=0.02mol,100mL 0.4mol•L-1的NaOH溶液中n(OH-)=CV=0.4mol/L×0.1L=0.04mol,混合后,NaOH过量,溶液显碱性,溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,由于水的离子积Kw=c(H+)•c(OH-)=10-12,故c(H+)=10-11mol/L,而pH=-lgc(H+)=11,
故答案为:11;
(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b;
故答案为:<;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
故答案为:Al3++3H2O?Al(OH)3+3H+;Al2O3;
( 6 ) ①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
点评 本题考查了酸碱反应后溶液酸碱性分析判断、离子浓度大小比、,盐类水解、溶度积常数的计算分析,掌握基础是关键,题目难度中等.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SiO3溶液的pH | Na2SiO3溶液的pH大 | 非金属性:C>Si |
| B | 将稀硫酸加入到碳酸钙中,排饱和食盐水收集气体 | 收集到一定量气体 | 实验室可用此法制备CO2 |
| C | 将4mL 0.01mol/L酸性KMnO4溶液与2mL 0.lmol/L草酸溶液混合 | KMnO4溶液褪色的速率先慢后加快 | 增大反应物浓度, 反应速率加快 |
| D | 将NO2气体通入石蕊试液中 | 溶液变红 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
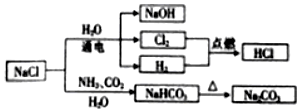
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 图中所示转化反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | H2与Cl2反应时产生苍白色火焰并形成白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准况状下,44.8 L四氯筑化碳含有的分子数为2NA | |
| B. | 0.1mol/L氯化铝溶液中含有Al3+数为0.1 NA | |
| C. | 1.8 g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cu2+ | |
| B. | pH=l的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1 Na2CO3溶液的pH约为11;0.1mol•L-1 NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
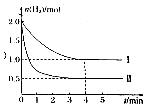 工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.
工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com