
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
科目:高中化学 来源: 题型:
【题目】类比归纳是学习化学的重要方法,对如下类比的说法正确的是( )
A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色
B.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
C.CO2与SiO2化学性质相似,CO2与SiO2都能与水反应
D.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
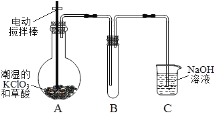
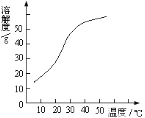
图1 图2
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。
已知Ⅰ.NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;
Ⅱ.NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④ ;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③原ClO2溶液的浓度为 g·L-1(用含字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将3mol A和2mol B充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),
C(g)+D(g),
5 min后达平衡,各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情
况下将容器的体积扩大为原来的10倍,B的转化率不发生变化,则B的转化率为( )
A. 60% B.40% C.24% D.4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0,下列叙述正确的是
4NO(g)+6H2O(g) △H<0,下列叙述正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A. 混合物:水玻璃、碱石灰、明矾 B. 酸:稀硫酸、次氯酸、硫酸氢钠
C. 酸性氧化物:SO2、CO2、SiO2 D. 碱性氧化物:CaO、Na2O2、K2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学原子经济要求的是( )
A. 乙烯聚合为聚乙烯高分子材料
B. 甲烷与氯气制备一氯甲烷
C. 以铁和浓HNO3为原料生产硝酸铁
D. 用碳来还原氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂,干燥的高铁酸钾在198 ℃以下是稳定的,受热易分解。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥
C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com