
【题目】下列化学用语表示正确的是( )
A. 过氧化钠的化学式: Na2O2
B. Mg2+的结构示意图: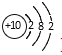
C. 明矾的化学式:Al2(SO4)3
D. 碳酸氢钠的电离方程式:CH3COOH=H+ + CH3COO-
科目:高中化学 来源: 题型:
【题目】2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的( )
A. Mc的原子核外有115个电子
B. Mc与N元素属于同一主族
C. Mc在同主族元素中金属性最强
D. 中子数为173的Mc核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中用途与其性质或原理对应关系不正确的是![]()
选项 | 现象或事实 | 解释 |
A |
|
|
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C |
|
|
D | 用小苏打治疗胃酸过多 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO、OH、FeO42-、Cl、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________。
②每生成1molFeO42-转移________mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br,2Fe2++Cl2===2Fe3++2Cl
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br被氧化一半时,c为_______________(用含a、b的代数式表示)。
(3)已知:S2O![]() 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
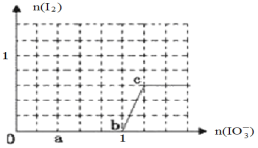
写出a点处还原产物是_______________;b点到c点反应的离子方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是__________。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_________________,工业上制备硅的方程式为 ______________________,氧化剂与还原剂的质量比为______________。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A. x=0.6a,2Br-+Cl2===Br2+2Cl-
B. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
C. x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D. x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
物质 | 除杂试剂 | 操作 | |
A | CO2 (HCl) | 氢氧化钠溶液 | 洗气 |
B | FeCl2 溶液 (FeCl3) | 铜粉 | 充分反应后过滤 |
C | Na2CO3固体(NaHCO3) | 无 | 充分加热 |
D | Fe2O3 (Al2O3) | 稀硫酸 | 充分反应后过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com