
ЁОЬтФПЁПЂёЃЎИпЬњЫсМиЃЈK2FeO4ЃЉЪЧвЛжжаТаЭЁЂИпаЇЁЂЖрЙІФмТЬЩЋЛЗБЃЫЎДІРэМСЃЌБШCl2ЁЂO2ЁЂClO2ЁЂKMnO4бѕЛЏадИќЧПЃЌЮоЖўДЮЮлШОЃЌгІгУЙуЗКЁЃЙЄвЕЩЯЪЧЯШжЦЕУИпЬњЫсФЦЃЌШЛКѓдкЕЭЮТЯТЃЌЯђИпЬњЫсФЦШмвКжаМгШыKOHжСБЅКЭЃЌЪЙИпЬњЫсМиЮіГіЁЃ
ЃЈ1ЃЉИЩЗЈжЦБИИпЬњЫсМиЕФжївЊЗДгІЮЊЃК2FeSO4ЃЋ6Na2O2===2Na2FeO4ЃЋ2Na2OЃЋ2Na2SO4ЃЋO2ЁќЃЌИУЗДгІбѕЛЏВњЮяЪЧ_____ЃЈЬюЛЏбЇЪНЃЉЁЃ
ЃЈ2ЃЉЪЊЗЈжЦБИИпЬњЫсМи(K2FeO4)ЕФЗДгІЬхЯЕжагаСљжжСЃзгЃКFe(OH)3ЁЂClOЁЂOHЁЂFeO42-ЁЂClЁЂH2OЁЃ
ЂйаДГіВЂХфЦНМюадЬѕМўЯТЪЊЗЈжЦИпЬњЫсМиЕФРызгЗДгІЗНГЬЪНЃК________________________________ЁЃ
ЂкУПЩњГЩ1molFeO42-зЊвЦ________molЕчзгЃЛШєЗДгІЙ§ГЬжазЊвЦСЫ0.3molЕчзгЃЌдђЛЙдВњЮяЕФЮяжЪЕФСПЮЊ________molЁЃ
ЂђЃЎбѕЛЏЛЙдЗДгІдкЩњВњЩњЛюжагІгУЙуЗКЃЌЫМПМЛиД№вдЯТЮЪЬт
вбжЊЃК2Fe3++2I===2Fe2++I2ЃЌ2Fe2++Br2===2Fe3++2BrЃЌ2Fe2++Cl2===2Fe3++2Cl
ЃЈ1ЃЉКЌга1mol FeI2КЭ2mol FeBr2ЕФШмвКжаЭЈШы2mol Cl2ЃЌДЫЪББЛбѕЛЏЕФРызгЪЧ________ЁЃ
ЃЈ2ЃЉШєЯђКЌa mol FeI2КЭb mol FeBr2ЕФШмвКжаЭЈШыc molCl2ЃЌЕБBrБЛбѕЛЏвЛАыЪБЃЌcЮЊ_______________ЃЈгУКЌaЁЂbЕФДњЪ§ЪНБэЪОЃЉЁЃ
ЃЈ3ЃЉвбжЊЃКS2O![]() ОпгаНЯЧПЕФЛЙдадЃЌЪЕбщЪвПЩгУIЃВтЖЈВтЖЈK2S2O8бљЦЗЕФДПЖШЃКгаЙиЗДгІЗНГЬЪНЮЊЃК I2+2S2O32-Ёњ2I+S4O62-ЃЌS2O82-+2IЁњ2SO42-+I2ЃЌдђS2O82-ЁЂS4O62-ЁЂI2бѕЛЏадЧПШѕЫГађЮЊЃК____________ЁЃ
ОпгаНЯЧПЕФЛЙдадЃЌЪЕбщЪвПЩгУIЃВтЖЈВтЖЈK2S2O8бљЦЗЕФДПЖШЃКгаЙиЗДгІЗНГЬЪНЮЊЃК I2+2S2O32-Ёњ2I+S4O62-ЃЌS2O82-+2IЁњ2SO42-+I2ЃЌдђS2O82-ЁЂS4O62-ЁЂI2бѕЛЏадЧПШѕЫГађЮЊЃК____________ЁЃ
ЃЈ4ЃЉвбжЊШмвКжаЃКЛЙдадHSO3->IЃЃЌбѕЛЏадIO3->I2>SO42-ЃЛЯђКЌ3molNaHSO3ЕФШмвКжаж№ЕЮМгШыKIO3ШмвКЃЌМгШыЕФKIO3КЭЮіГіЕФI2ЕФЮяжЪЕФСПЕФЙиЯЕЧњЯпШчЯТЭМЫљЪОЁЃ
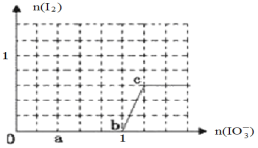
аДГіaЕуДІЛЙдВњЮяЪЧ_______________ЃЛbЕуЕНcЕуЗДгІЕФРызгЗНГЬЪН________________
ЁОД№АИЁПNa2FeO4ЁЂO2 2Fe(OH)3+3ClO+4OH = 2FeO42-+ 3Cl+5H2O 3 0.15 IЁЂFe2+ (3a+2b)/2 S2O82->I2 >S4O62- I IO3-+5I-+6H+=3I2 +3H2O
ЁОНтЮіЁП
I.ЃЈ1ЃЉбѕЛЏВњЮяЪЧЛЙдМСБЛбѕЛЏЃЌFeSO4жаЃЋ2МлFeзЊЛЏГЩЃЋ6МлЃЌЛЏКЯМлЩ§ИпЃЌNa2O2жаЃ1МлOЁњ0МлЃЌЛЏКЯМлЩ§ИпЃЌвђДЫЪєгкбѕЛЏВњЮяЕФЪЧNa2FeO4ЁЂO2ЃЛ
ЃЈ2ЃЉЂйжЦБИИпЬњЫсМиЃЌFeЕФЛЏКЯМлЩ§ИпЃЌМДClOЃзїбѕЛЏМСЃЌБЛЛЙдГЩClЃЃЌЛЗОГЮЊМюадЃЌвђДЫЪЊЗЈжЦИпЬњЫсМиЕФРызгЗНГЬЪНЮЊ2Fe(OH)3ЃЋ3ClOЃЃЋ4OHЃ=2FeO42ЃЃЋ3ClЃЃЋ5H2OЃЛ
ЂкУПЩњГЩ1molFeO42ЃЃЌзЊвЦЕчзгЮяжЪЕФСПЮЊ1molЁС(6Ѓ3)=3molЃЌЛЙдВњЮяЪЧClЃЃЌClЕФЛЏКЯМлгЩЃЋ1МлЁњЃ1МлЃЌЛЏКЯМлБфЛЏ2МлЃЌвђДЫзЊвЦЕчзгЮяжЪЕФСП0.3molЃЌЩњГЩn(ClЃ)=0.3mol/2=0.15molЃЛ
II.ЃЈ1ЃЉИљОнЬтжаЫљИјЗДгІЗНГЬЪНЃЌЕУГіЛЙдадЧПШѕЕФЫГађЪЧIЃ>Fe2>BrЃЃЌЯђИУЛьКЯШмвКжаЭЈШыТШЦјЃЌЗДгІЕФЯШКѓЫГађЪЧ2IЃЃЋCl2=2ClЃЃЋI2ЁЂ2Fe2ЃЋЃЋCl2=2Fe3ЃЋЃЋ2ClЃЁЂ2BrЃЃЋCl2=Br2ЃЋ2ClЃЃЌЛьКЯвКжаКЌга2molIЃЃЌЯћКФCl2ЕФЮяжЪЕФСПЮЊ1molЃЌЛЙЪЃ1molCl2ЃЌFe2ЃЋЮяжЪЕФСПЮЊ3molЃЌЭъШЋЗДгІЪБЃЌЯћКФCl2ЕФЮяжЪЕФСПЮЊ3mol/2=1.5mol>1molЃЌвђДЫжЛгаБЛбѕЛЏЕФFe2ЃЋЮяжЪЕФСПЮЊ2molЃЌзлЩЯЫљЪіЃЌБЛбѕЛЏЕФРызггаIЃКЭFe2ЃЋЃЛ
ЃЈ2ЃЉИљОнЕУЪЇЕчзгЪ§ФПЪиКугаЃК2amolЁС1ЃЋ(aЃЋb)molЁС1ЃЋ2bЁС1/2=cmolЁС2ЁС1ЃЌНтЕУc=(3aЃЋ2b)/2ЃЛ
ЃЈ3ЃЉвРОнбѕЛЏМСЕФбѕЛЏадЧПгкбѕЛЏВњЮяЕФбѕЛЏадЃЌИљОнРызгЗНГЬЪНЕФЯШКѓЫГађЕУГібѕЛЏадЧПШѕЫГађЪЧI2>S4O62ЃЁЂS2O82Ѓ>I2ЃЌбѕЛЏадЧПШѕЫГађЪЧS2O82Ѓ>I2>S4O62ЃЃЛ
ЃЈ4ЃЉИљОнЛЙдадвдМАбѕЛЏадЧПШѕЕФЫГађЃЌIO3ЃНЋSO32ЃбѕЛЏГЩSO42ЃЃЌБОЩэБЛЛЙдГЩIЃЃЌМД0ЁЋ1ЖЮЗЂЩњРызгЗНГЬЪНЮЊIO3ЃЃЋ3HSO3Ѓ=IЃЃЋ3SO42ЃЃЋ3HЃЋЃЌМДaЕуЛЙдВњЮяЮЊIЃЃЛbЁњcЗЂЩњРызгЗНГЬЪНЮЊЃКIO3Ѓ+5IЃ+6HЃЋ=3I2 +3H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. 22.4L O2ЕФЮяжЪЕФСПдМЮЊ1mol
B. 4.4g CO2КЌгаЕФдзгЪ§ЮЊ0.3NA
C. 1mol/LЕФCuSO4ШмвКжаSO42ЁЊЕФЮяжЪЕФСПЮЊ1mol
D. БъзМзДПіЯТЃЌ11.2L H2OЕФЮяжЪЕФСПдМЮЊ1mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФОЬѕгіЕНХЈСђЫсБфКкЃЌетЬхЯжСЫХЈСђЫсЕФ(ЁЁЁЁ)
A.ЮќЫЎадB.ЭбЫЎадC.ЫсадD.ЛЙдад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗНАИФмДяЕНЪЕбщФПЕФЕФЪЧ(ЁЁЁЁ)
A.гУбЮЫсГ§ШЅУОЗлжаЕФЩйСПТСЗл
B.гУМгШШЁЂГЦжиЕФЗНЗЈМјБ№Na2CO3ЙЬЬхКЭNaHCO3ЙЬЬх
C.гУХЈСђЫсИЩдяАБЦј
D.гУХХЫЎЗЈЪеМЏNO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжаЙњХЎвЉбЇМвЭРпЯпЯвђбажЦаТаЭПЙХБвЉЧрняЫиКЭЫЋЧтЧрняЫиГЩЙћЖјЛёЕУ2015ФъХЕБДЖћЩњРэбЇЛђвНбЇНБЁЃЧрняЫиКЭЫЋЧтЧрняЫиНсЙЙШчЯТЭМЫљЪОЃЌНсЙЙжаКЌгаКЭЫЋбѕЫЎ(H-O-O-H)РрЫЦЕФЁА-O-O-ЁБЙ§бѕМќЁЃ
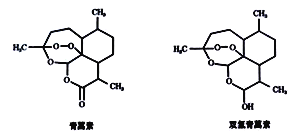
ЯТСаЙигкЧрняЫиКЭЫЋЧтЧрняЫиЕФЫЕЗЈе§ШЗЕФЪЧ
A. ЧрняЫиКЭЫЋЧтЧрняЫиОљФмЩБОњЯћЖОЃЌЧвОљПЩвдЪЙЕУЫсадИпУЬЫсМиЭЪЩЋ
B. ЧрняЫиКЭЫЋЧтЧрняЫиЭъШЋШМЩеЕФКФбѕСПЯрЭЌ
C. ЧрняЫиЭЈЙ§бѕЛЏЗДгІПЩжЦЕУЫЋЧтЧрняЫи
D. ЧрняЫиКЭЫЋЧтЧрняЫидкЯЁСђЫсДпЛЏЬѕМўЯТОљФмЗЂЩњЫЎНтЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪМфЕФУПВНзЊЛЏжЛашЭЈЙ§вЛВНЗДгІОЭФмЪЕЯжЕФЪЧ
A. SЁњSO3ЁњH2SO4ЁњNa2SO3 B. AlЁњAl (OH)3ЁњAl2O3ЁњNa[Al(OH)4]
C. NaЁњNa2O2ЁњNa2CO3ЁњNaOH D. SiЁњSiO2ЁњH2SiO3ЁњNa2SiO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇгУгяБэЪОе§ШЗЕФЪЧ( )
A. Й§бѕЛЏФЦЕФЛЏбЇЪНЃК Na2O2
B. Mg2+ЕФНсЙЙЪОвтЭМЃК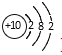
C. УїЗЏЕФЛЏбЇЪНЃКAl2(SO4)3
D. ЬМЫсЧтФЦЕФЕчРыЗНГЬЪНЃКCH3COOHЃНH+ + CH3COO-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНБэДяе§ШЗЕФЪЧЃЈ![]() ЕФОјЖджЕОље§ШЗЃЉ
ЕФОјЖджЕОље§ШЗЃЉ
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) ЁїH=ЈC1367.0 kJ/molЃЈШМЩеШШЃЉ
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ЁїH= +57.3kJ/molЃЈжаКЭШШЃЉ
C. S(s)+O2(g)=SO2(g) ЁїH=ЈC269.8kJ/mol ЃЈЗДгІШШЃЉ
D. 2NO2=O2+2NO ЁїH= +116.2kJ/mol ЃЈЗДгІШШЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉаДГіЂйЁЂЂкСНжждЊЫиЕФУћГЦ______ ЃЌ______ЁЃ
ЃЈ2ЃЉетаЉдЊЫиЕФзюИпМлбѕЛЏЮяЕФЖдгІЫЎЛЏЮяжа________МюадзюЧПЃЛФмаЮГЩСНадЧтбѕЛЏЮяЕФдЊЫиЪЧ________ЁЃ
ЃЈ3ЃЉБШНЯЂнгыЂоЕФЛЏбЇаджЪЃЌ________ИќЛюЦУЃЌЪдгУЪЕбщжЄУїДЫЯжЯѓЃЈМђЪіВйзїЁЂЯжЯѓКЭНсТлЃЉ _______ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com