
【题目】下列方案能达到实验目的的是( )
A.用盐酸除去镁粉中的少量铝粉
B.用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体
C.用浓硫酸干燥氨气
D.用排水法收集NO2
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白:
周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)上述元素中,形成化合物种类最多的是______(填元素符号)。
(2)元素①、④和⑤形成的化合物的电子式是______,该化合物中存在的化学键类型是______。
(3)②、③、⑦三种元素原子半径由大到小的顺序是______(用元素符号表示)。
⑤、⑥、⑦、⑧、⑨、⑩六种元素形成的简单离子,半径最小的是_________,最大的是___________(填离子符号)。
(4)⑤、⑥、⑦三种元素最髙价氧化物对应水化物的碱性由强到弱的顺序是______(用对应物质的化学式表示)。
(5)最易形成离子键的两种元素代号是_____________。
(6)能比较元素⑨和⑩非金属性强弱的实验事实是______(填字母序号)。
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物在水中的电离方程式不正确的是( )
A.CaCl2═Ca2++2Cl﹣B.NH4Cl═NH4++Cl﹣
C.KClO3═K++Cl﹣+3O2﹣D.HNO3═H++NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由前18号元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
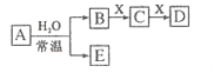
A. 若D为白色沉淀,与A摩尔质量相等,则X一定是含铝元素的盐
B. 若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其阳离子与阴离子比为2:1
D. 若X是Na2CO3,C为CO2分子,则A一定是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中用途与其性质或原理对应关系不正确的是![]()
选项 | 现象或事实 | 解释 |
A |
|
|
B | 常用铝箔做包装材料 | 金属铝有好的延展性 |
C |
|
|
D | 用小苏打治疗胃酸过多 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y,已知X的质子数为a,X2+比Y2-核外少8个电子,若Y原子的质量数为b,则Y原子核内中子数为( )
A. b-a-4 B. b-a-8 C. b+a+8 D. b-a-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO、OH、FeO42-、Cl、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________。
②每生成1molFeO42-转移________mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br,2Fe2++Cl2===2Fe3++2Cl
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br被氧化一半时,c为_______________(用含a、b的代数式表示)。
(3)已知:S2O![]() 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
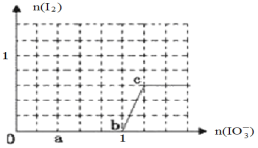
写出a点处还原产物是_______________;b点到c点反应的离子方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A. x=0.6a,2Br-+Cl2===Br2+2Cl-
B. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
C. x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D. x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图实验装置,能得出相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | H2O | 电石 | KMnO4 | 乙炔具有还原性 | |
D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com