
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
科目:高中化学 来源: 题型:
【题目】下列物质反应后出现黄色的是( )
A. 淀粉遇碘 B. 在新制氢氧化铜中加入葡萄糖溶液
C. 蛋白质与浓硝酸作用 D. 乙醇、乙酸和浓硫酸混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在燃烧2.24L(标准状况)CO与O2的混合气体时,放出11.32kJ的热量,最后产物的密度为原来气体密度的1.25倍,则CO的燃烧热为
A. 283 kJ·mol-1 B. -283 kJ·mol-1 C. -566 kJ·mol-1 D. 566kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是

A. x=4
B. 若N中气体的密度如图Ⅲ所示,则A、B可能都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( ) 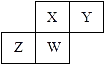
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素Y,Z形成的化合物是制造光电池的主要材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com