
����Ŀ���ظ������Һ�д�������ƽ�⣺��1��Cr2O72-+H2O![]() 2H++2CrO42-����2mL0.1mol��L-1�ữ��K2Cr2O7��Һ�е�������(NH4)2Fe(SO4)2��Һ��������Ӧ��Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O�����з�����ȷ����
2H++2CrO42-����2mL0.1mol��L-1�ữ��K2Cr2O7��Һ�е�������(NH4)2Fe(SO4)2��Һ��������Ӧ��Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O�����з�����ȷ����
A. ��K2Cr2O7��Һ���뼸��ŨNaOH��Һ����Һ�ɻ�ɫ��ɳȻ�
B. �����ԣ�Cr2O72-��Fe3+
C. CrO42-��Fe2+��������Һ���ܴ�������
D. ��K2Cr2O7��Һ�м�ˮϡ�ͣ���Ӧ��1��ƽ�������ƶ�
���𰸡�B
��������A����������������Һ��ƽ��������У���Һ�ɳ�ɫ��Ϊ��ɫ����A����B����Ӧ��Cr2O72-+14H++6Fe2+�T2Cr3+(��ɫ)+6Fe3++7H2O���������������Դ��������������ʵ�����˵�������ԣ�Cr2O72-��Fe3+����B��ȷ��C��CrO42-���������ԣ���������Һ���������������ӣ�CrO42-��Fe2+��������Һ�в����Դ������棬��C����D��ϡ��K2Cr2O7��Һʱ������Ũ�ȼ�С����ƽ�ⳣ�����䣬���ƽ��������Ӧ�����ƶ�����D����ѡB��
��⣺������״���ΪD��ϡ����Һ������Ũ�ȼ�С�����¶Ȳ��䣬ƽ�ⳣ�����䣬������Һ���ϡ��Ϊԭ����2������Qc=![]() K��K��ƽ�������ƶ���
K��K��ƽ�������ƶ���


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��Ⱥ����Ӽ��ֺ����ۼ����ǣ�������
A.NaClB.CO2C.NaOHD.N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ�����������ش��ָ�����塣�ش��������⣺
��1���������¶���ͬ���ܱ�����A��B��A�����ݻ����䣬B����ѹǿ���䣬��ʼʱ���ݻ���ȵ�A��B�зֱ���������C��H2O(g)��������Ӧ��C(s)+H2O(g)![]() CO(g)+ H2(g) ������ӦΪ���ȷ�Ӧ�������ֱ�ﵽƽ�⡣
CO(g)+ H2(g) ������ӦΪ���ȷ�Ӧ�������ֱ�ﵽƽ�⡣
�ٴﵽƽ�������ʱ�䣺t(A)_____t(B)��H2O�����������V(A)%_____V(B)%��(����>������<�� ��=��)
�ڴﵽƽ������������зֱ�ͨ������ĺ�������A��H2O��ת����_________(���������� ����С������������)��B�л�ѧƽ��________�ƶ�(����������������Ӧ�����������淴Ӧ������)��
��2��ij�¶��£����0.01mol��L-1NaOH��Һ��pH=10�����ڸ��¶���Kw=______���ڴ��¶��£���pH=11��NaOH��ҺaL��pH=2��H2SO4��ҺbL��ϣ���������ҺΪ���ԣ���a:b=_______����������ҺpH=10����a:b=_______(������ʱ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������21.6g��CO��CO2��ɵĻ�����壬�ڱ���������Ϊ13.44L���ش��������⣺ 
��1���û�������ƽ��Ħ������Ϊ
��2�����������̼ԭ�ӵ�����Ϊ
��3���������������ͨ������ͼ��ʾװ�ã�����ռ��������У�ʵ���ڱ���²ⶨ�� ���������ռ����������Ħ������Ϊ
����������ΪL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1molA(g)��1molB(g)����2L�ܱ������з�����Ӧ����t1ʱ�ﵽƽ�⣺A(g)+B(g) ![]() xC(g)+D(s)����t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C(g)��Ũ����ʱ��仯��ͼ��ʾ�������й�˵����ȷ����
xC(g)+D(s)����t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C(g)��Ũ����ʱ��仯��ͼ��ʾ�������й�˵����ȷ����

A. t1~t3��÷�Ӧ��ƽ�ⳣ����ͬ����Ϊ0.25 B. t2ʱ�̸ı��������ʹ�ô���
C. t3ʱ�̸ı����������ȥ��������D D. ��Ӧ����ʽ��x=2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ����500mL0.2mol/L����������Һ��ʵ�鲽������У�
��1������д����հ״���
A������ƽ�ϳƳ� g�����ƹ��壬���������ձ��������������ˮ�ܽ⣮
B���ѵõ�����ҺС�ĵ����Ų�����ע�� mL������ƿ�У�
C������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ��ҺҲС��ת������ƿ�У�
D������������ƿ�м�����ˮ��Һ���̶�1��2cm�������� С�ĵμ�����ˮ����Һ��Һ��ײ���̶���ˮƽ���У�
E����ƿ�����������ҡ�ȣ�
F������õ���Һ�����Լ�ƿ�У����ϱ�ǩ����ϴ������ƿ��
��2�����������ʹ������ҺŨ��ƫ�ߵ��� ������ţ���
������ƿ��ǰ�ڱ�մ��ˮ�� ��û�н��������IJ�������C
��δ��ȴ�����¾�ע������ƿ���� �ܶ���ʱ��ˮ�Ӷ��ˣ��õι�����
�ݶ���ʱ����������ƿ�̶��� ����ʱ����������ƿ�̶���
��3�����ʵ������98%��Ũ���ᣨ�ܶ�Ϊ1.8gcm��3�� ���� 3.6molL��1��ϡ����150mL����������Ũ��������Ϊ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ������ȷ���ǣ�![]() �ľ���ֵ����ȷ��
�ľ���ֵ����ȷ��
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) ��H=�C1367.0 kJ/mol��ȼ���ȣ�
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ��H= +57.3kJ/mol���к��ȣ�
C. S(s)+O2(g)=SO2(g) ��H=�C269.8kJ/mol ����Ӧ�ȣ�
D. 2NO2=O2+2NO ��H= +116.2kJ/mol ����Ӧ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����ʵķ��������е��ǣ� ��
A.�ù�����ˮ��ȥAl3����Һ�е�����Fe3��
B.���������ͨ�����ȵ�ͭ����N2�е�����O2
C.�����Ƶ���ʯ�ң�ͨ�����������Գ�ȥ�Ҵ��е�����ˮ
D.�������ȥAgCl��������Ag2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ˮ�в��ֺ��ȵ����ֵķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵İٷ�������pH�Ĺ�ϵ����ͼ��ʾ��������������ȷ����( )
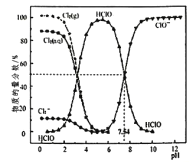
A. ������ˮ�г���ͨ��SO2��pH���ϱ�С����Һ��ɫ���ϱ�dz
B. ���Ƶ�pH=l����ˮ�У�c(H+)>c(Cl3-)>c(HClO)
C. 25��ʱ��HC1O![]() H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
H++ClO-�ĵ��볣��Ka�Ķ���ֵΪlgKa=-7.54
D. pH=6����ˮ�м���NaOH��Һ����Ҫ���������ӷ�Ӧ����ʽΪCl2+2OH-=ClO-+C1-+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com