
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,A保持容积不变,B保持压强不变,起始时向容积相等的A、B中分别充入等量的C和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①达到平衡所需的时间:t(A)_____t(B);H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_________(填“增大” “减小”、“不变”);B中化学平衡________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______;若所得溶液pH=10,则a:b=_______(假设混合时体积不变)。
【答案】 > < 不变 向正反应力向 1![]() 10-12 1:10 2:9
10-12 1:10 2:9
【解析】本题主要考查化学平衡的移动。
(1)①该反应气体物质的量减少,A相当于B减压而成,减压反应速率减小,所以达到平衡所需的时间:t(A)>t(B);减压平衡右移,H2O的体积分数:V(A)%<V(B)%。
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率不变;B中相当于减压,化学平衡向正反应方向移动。
(2)该溶液中c(H+)= ![]() mol/L,c(OH-)=0.01mol/L,则在该温度下Kw=1
mol/L,c(OH-)=0.01mol/L,则在该温度下Kw=1![]() 10-12;在此温度下,pH=11的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液中c(H+)=0.01mol/L,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则0.1a=0.01b,a:b=1:10;若所得溶液pH=10,溶液中c(OH-)=0.01mol/L,则0.1a-0.01b=0.01(a+b),a:b=2:9。
10-12;在此温度下,pH=11的NaOH溶液中c(OH-)=0.1mol/L,pH=2的H2SO4溶液中c(H+)=0.01mol/L,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则0.1a=0.01b,a:b=1:10;若所得溶液pH=10,溶液中c(OH-)=0.01mol/L,则0.1a-0.01b=0.01(a+b),a:b=2:9。


科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是 ( )
A. 多数合金的硬度一般比其各成分金属的硬度高
B. 多数合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的物理性质不同
D. 合金的化学性质一般与其各成分金属的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后出现黄色的是( )
A. 淀粉遇碘 B. 在新制氢氧化铜中加入葡萄糖溶液
C. 蛋白质与浓硝酸作用 D. 乙醇、乙酸和浓硫酸混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行物质导电性实验测定时,按照图a、图b分别接通线路,下列叙述正确的是( ) 
A.NaCl是电解质,图a、图b灯泡均会发光
B.图a灯泡不会发光,NaCl固体中不含Na+、Cl﹣
C.NaCl溶液在通电后发生:NaCl═Na++Cl﹣
D.通电前图b溶液由大量H2O、Na+、Cl﹣ 构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂进行了如下实验,请填写下列空白:
试剂:5%H2O2 溶液,10%H2O2 溶液,1mol·L-1FeCl3 溶液
仪器: 试管、胶头滴管、酒精灯
(1)实验目的:探究温度对化学反应速率的影响
实验步骤:分别向A、B 两支试管中加5 mL 5 % H2O2溶液,将试管A 放入5℃ 水浴中,将试管B 放入40℃水浴中,同时分别向两试管中加入2~3 滴1mol·L-1FeCl3 溶液,观察实验现象。
实验现象:试管_________(填A 或B)中产生气泡的速率快,说明_________________。
(2)实验目的:探究浓度对化学反应速率的影响
实验步骤:向试管A 中加入5 mL5%H2O2溶液,向试管B 中加入5 mL10%H2O2溶液,观察实验现象。
实验现象:试管A、B 中均有少量气体缓慢产生。
请你改进实验方案,使该实验的实验现象更为明显,以支撑“浓度改变会影响化学反应速率”这一理论预测。______________________________________
(3)实验目的:____________________________。
实验步骤:分别向试管A 和B 中加入5 mL 5%H2O2溶液后,再向试管B 中加入1mol·L-1FeCl3 溶液,观察实验现象。
你认为方案(3) 的设计是否严谨?_______(填是或否),说明理由___________________。
(4)下列有关影响化学反应速率的因素的说法错误的是__________(填字母)。
a.对于已经达到化学平衡状态的反应A(g)![]() B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动
B(g)+C(g) △H >0,其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,所以平衡正向移动
b.其他条件不变时,增大压强一定能加快化学反应速率
c.其他条件不变时,使用正催化剂,活化分子百分数增大,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种用途广泛的氧化剂,可由软锰矿制备。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_______(填字母)。
a.75%酒精 b.双氧水 c.“84”消毒液(NaClO溶液)
(2)取制得的KMnO4产品2.0000g,溶于水配成250mL 溶液,取出25.00mL 于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5 min 左右,然后加入数滴淀粉溶液作指示剂,用0.2500 mol·L-1标准Na2S2O3 溶液进行滴定,滴定至终点消耗Na2S2O3 溶液20.00 mL。
已知:I2+2S2O3-=2I-+ S4O62-,杂质不参加反应。
①滴定终点的现象是________________________________;
②已知KMnO4在酸性条件下能被KI还原为Mn2+,写出该反应的离子方程式___________;
③计算KMnO4产品的纯度_______。(写出计算过程)
④若盛装标准Na2S2O3溶液的滴定管未润洗,则会使KMnO4产品的纯度___________(填“偏高”、 “偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( ) 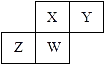
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素Y,Z形成的化合物是制造光电池的主要材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com