
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
【答案】A
【解析】本题考查了盖斯定律、元素守恒等知识。盖斯定律的定义为只要始态和终态不变,无论是一步完成还是分几步完成,其反应热相同,C→CO2, C→CO→CO2,根据元素守恒,C、CO和CO2的物质的量相同,故①对。S和O2不能直接生成SO3,故②错。Na→Na2O2,Na→Na2O→Na2O2,根据元素守恒,Na2O、Na2O2的物质的量是Na物质的量的1/2,故③错。AlCl3→NaAlO2,AlCl3→Al(OH)3→NaAlO2,根据元素守恒,AlCl3、Al(OH)3和NaAlO2的物质的量相同,故④对。Fe→Fe(NO3)2,Fe→Fe(NO3)3→Fe(NO3)2,根据元素守恒,Fe、Fe(NO3)2和Fe(NO3)3的物质的量相同,故⑤对。NaOH→NaHCO3,NaOH→Na2CO3→NaHCO3,根据元素守恒,NaOH、NaHCO3的物质的量为Na2CO3的2倍,故⑥错。故该题选A。


科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数是17,那么氯元素在元素周期表中的位置是 ( )
A. 第2周期ⅦA族 B. 第3周期ⅦA族
C. 第3周期ⅥA族 D. 第3周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量( )
A. ①比②多 B. ②比①多 C. 两种方法一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
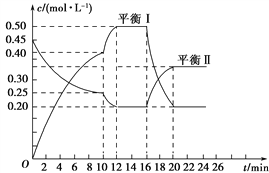
(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA
B. 1.5 mol CH4所含的电子数为15 NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
D. 常温常压下,11.2 L Cl2含氯原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:( )
A. A>B>C>D B. A>C>D>B C. C>A>B>D D. B>D>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com