
 ,
, ;
;| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-11 |


科目:高中化学 来源: 题型:
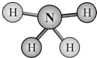 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
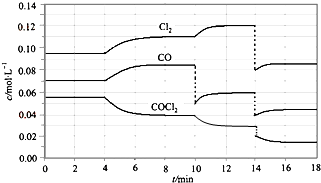 光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )
光气的分解反应为:COCl2(g)═Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是 ( )| A、从第10 min到第12 min时,生成Cl2的速率v(Cl2)=0.01 mol?L-1?min-1 |
| B、第8 min时与第18 min时反应的平衡常数相同 |
| C、由于10 min时条件的改变,使COCl2的转化率降低 |
| D、在第14 min时,改变的条件可能是压缩反应容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
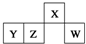 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:rW>rZ>rY>rX |
| B、含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中由水电离出的c(H+)1×10-a mol/L,若a>7时,该溶液pH一定为14-a |
| B、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)>c(HR-)>c(Na+) |
| C、将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-) |
| D、CaCO3是一种难溶物质,其KSP=2.8×10-9(25℃),若将等体积bmol/LCaCl2溶液与2×10-5mol/LNa2CO3溶液混合,则生成沉淀所需原CaCl2溶液的b值至少为1.4×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的醋酸加水稀释100倍后,溶液pH值等于4 |
| B、室温下,物质的量浓度相同的苯甲酸钠溶液比碳酸钠溶液的碱性强 |
| C、相同温度下,pH=2的氯化铁溶液中水的电离度比pH=1的硫酸溶液中水的电离度大 |
| D、pH=3的溶液与pH=11的溶液等体积混合后,溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com