
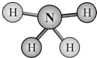
 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |


科目:高中化学 来源: 题型:
| A、BaCl2+H2SO4=BaSO4↓+2HCl |
| B、Ba(OH)2+Na2SO4=BaSO4↓+2NaOH |
| C、Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 |
| D、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
48 22 |
50 22 |
A、
| ||||
B、
| ||||
C、
| ||||
D、分别由
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铜与硫酸混合:O2-+2H+=H2O |
| B、澄清的石灰水跟盐酸反应:Ca2++2Cl-=CaCl2 |
| C、Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑ |
| B、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.
某研究性学习小组的同学在实验室对Cl2使有色物质褪色的机理进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com