
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| n |
| V |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |


科目:高中化学 来源: 题型:
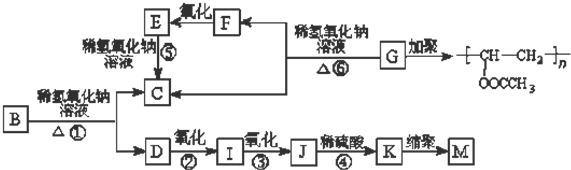
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
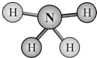 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铁放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、将少量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-═SO32-+H2O |
| D、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
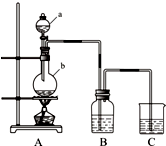 利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:
利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中由水电离出的c(H+)1×10-a mol/L,若a>7时,该溶液pH一定为14-a |
| B、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)>c(HR-)>c(Na+) |
| C、将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>C(Na+)>c(A-) |
| D、CaCO3是一种难溶物质,其KSP=2.8×10-9(25℃),若将等体积bmol/LCaCl2溶液与2×10-5mol/LNa2CO3溶液混合,则生成沉淀所需原CaCl2溶液的b值至少为1.4×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com