
【题目】人们把食品分为绿色食品、蓝色食品、白色食品等。绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品。下列食品属于白色食品的是
A. 甜酒 B. 甘蔗 C. 海带 D. 食盐
科目:高中化学 来源: 题型:
【题目】36.5gHCl气体溶解在1L水中(水的密度近似为1g/cm3),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5gHCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是( )
A. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
B. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
C. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 ![]() 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___ _______pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当量的CO,于是英国耗巨资把烟囱建高,根据所学知识回答问题。
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法错误的是( )
A.能够节约原料和能源
B.能提高产品的产量
C.能够提高化学反应速率
D.能够提高经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α(H2) |
(2)相同温度,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。(用含有a、b、c、d、m、n、x、y的一个代数式表示)
(3)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O=NH4++OH-的焓变约为( )(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D. 缺少数据无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修1有机化学基础】
A是一种五元环状化合物,其核磁共振氢谱只有一个峰;X是一种良好的溶剂;F的核磁共振氢谱有3个峰,峰面积之比为2 :2 :3;G是一种合成橡胶和树脂的重要原料。A→G转化关系如下:
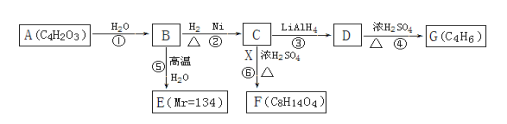
已知:
请填写下列空白。
(1)写出A的结构简式: ,1molA和足量的H2反应最多消耗掉H2的物质的量为 。
(2)B中含有非氧官能团的名称是______________;⑤的反应类型是___________。
(3)G按系统命名法应命名为_________________。
(4)若E在一定条件下能脱水生成六元环状化合物,写出该六元环化合物的结构简式:__________________。
(5)反应⑥的化学方程式为________ ________。
(6)有机物H与E互为同分异构体,且官能团的种类和数目相同,写出所有符合条件的H的结构简式: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
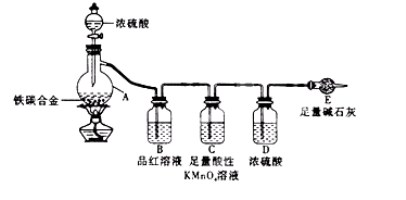
Ⅰ 探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是: _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_______________________(任写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是______________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
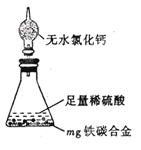
A. 用排水法测定H2的体积
B. 反应结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com