
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是

A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
【答案】D
【解析】
放电时,LixC6在负极(铜箔电极)上失电子发生氧化反应,其负极反应为:LixC6-x e-=x Li++6C,其正极反应即在铝箔电极上发生的反应为:Li1-xFePO4+x Li++x e-=LiFePO4,充电电池充电时,正极与外接电源的正极相连为阳极,负极与外接电源负极相连为阴极,
A.放电时,LixC6在负极上失电子发生氧化反应,其负极反应为:LixC6-x e-=x Li++6C,形成Li+脱离石墨向正极移动,嵌入正极,故A项正确;
B.原电池内部电流是负极到正极即Li+向正极移动,负电荷向负极移动,而负电荷即电子在电池内部不能流动,故只允许锂离子通过,B项正确;
C.充电电池充电时,原电池的正极与外接电源的正极相连为阳极,负极与外接电源负极相连为阴极,放电时,正极、负极反应式正好与阳极、阴极反应式相反,放电时Li1-xFePO4在正极上得电子,其正极反应为:Li1-xFePO4+x Li++x e-=LiFePO4,则充电时电池正极即阳极发生的氧化反应为:LiFePO4-x e-= Li1-xFePO4+x Li+,C项正确;
D.充电时电子从电源负极流出经铜箔流入阴极材料(即原电池的负极),D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )

A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学用含有铁锈的废铁屑制取氯化铁的装置(省略夹持装置,气密性完好)。下列说法正确的是

A. 装置A中存在反应:2Fe3++Fe=3Fe2+
B. 实验开始时,打开活塞a,盐酸快速流人装置A中
C. 装置B中收集到的气体可直接点燃
D. 反应后的烧杯中通入少量SO2,溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙都是二元固体化合物,将32g的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量![]() 溶液,过滤、洗涤、干燥得沉淀
溶液,过滤、洗涤、干燥得沉淀![]() ;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量的乙,加入稀盐酸使其完全溶解,溶液分为A、B两等分,向A中加入足量NaOH溶液,过滤、洗涤、灼烧得到红棕色固体28g,经分析乙与红棕色固体组成元素相同,向B中加入![]() 铜粉充分反应后过滤、洗涤、干燥得固体
铜粉充分反应后过滤、洗涤、干燥得固体![]() 。
。
![]() 写出构成甲的阴离子的结构示意图______,32g甲在足量浓硝酸中反应转移的电子数为______。
写出构成甲的阴离子的结构示意图______,32g甲在足量浓硝酸中反应转移的电子数为______。
![]() 乙的化学式______;稀硫酸溶解乙的化学方程式______。
乙的化学式______;稀硫酸溶解乙的化学方程式______。
![]() 将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______,设计实验证明此步反应后的溶液中金属元素的化合价______。
将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为______,设计实验证明此步反应后的溶液中金属元素的化合价______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3![]() 6C+Li3V2(PO4)3。下列有关说法正确的是
6C+Li3V2(PO4)3。下列有关说法正确的是
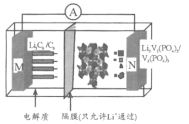
A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示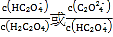 ,下列叙述错误的是
,下列叙述错误的是
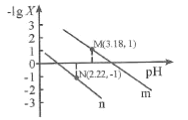
A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与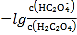 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com