
A.1∶1 B.1∶2
C.4∶1 D.3∶1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A.1∶1 B.2∶5
C.4∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源:2014届福建省四地六校高一下学期第一次联考化学试卷 题型:选择题
向Fe2O3、CuO、Fe、Cu的混和粉未中加入过量的稀硫酸,充分反应后,仍有红色粉未存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C. 一定有Fe2+,可能有Cu2+ D.只有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
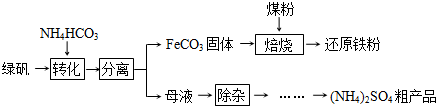
 FeO
FeO  Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式______.
Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式______.| 空气通入量/L?s-1 | 温度/℃ | SO2含量/% | SO3含量/% |
| 0.02 | 850 | 45.4 | 54.6 |
| 0.06 | 850 | 30.5 | 69.5 |
| 0.10 | 850 | 11.1 | 88.9 |
| 0.10 | 810 | 11.1 | 88.9 |
| 0.10 | 890 | 11.2 | 88.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com