
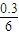 ×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
×3mol=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;

科目:高中化学 来源: 题型:阅读理解
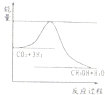
 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度分别为1 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,如果溶液中还有一定量的Cu2+,则溶液中一定含有的金属离子还有________________,该离子在溶液中的物质的量范围____________________,
可能含有的金属或金属离子为____________。
(2)反应完毕后,铁粉有剩余,溶液中一定含有的金属离子为___________,为______mol,一定没有的金属离子为______________。
(3)若向FeCl3溶液中加入适量氢碘酸,发生反应的离子方程式为____________________。
(4)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O。该反 应的化学方程式为________________________________;若反应过程中转移了0.3mol 电子,则氧化产物的质量是___________g;生成的气体在标况下的体积是________L。
查看答案和解析>>
科目:高中化学 来源:2013年山东省高考化学模拟试卷(三)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
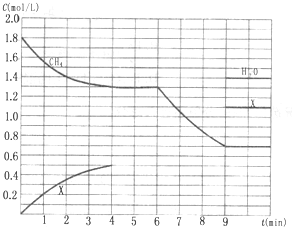
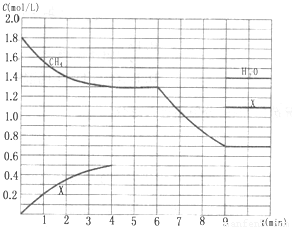
在某一容积为5 L的密闭容器内,加入
 0.3 mol的CO和0.3 mol的H2O,在催化剂存
0.3 mol的CO和0.3 mol的H2O,在催化剂存
在和800℃的条件下加热,发生如下反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反
CO2(g)+H2(g) ΔH>0,反
应中CO2的浓度随时间变化情况如右图:
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com