
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △H<0且△S<0的反应一定能自发发生 |
分析 A.反应是否自发进行有焓变熵变温度共同决定,△H-T△S<0,反应自发进行;
B.反应是否自发进行有焓变熵变温度共同决定,△H-T△S<0,反应自发进行;
C.△H-T△S>0反应非自发进行,反应△S>0,△H>0;
D.反应自发进行即△H-T△S<0,反应还受温度影响.
解答 解:A.焓减小的反应是放热反应,△H<0,反应不一定自发进行,能够自发进行的反应不一定是焓减小的反应,当△H>0,△S>0,高温下自发进行,故A错误;
B.熵增加的反应△S>0,不一定是自发进行,能够自发进行的反应不一定都是熵增加的反应,△S<0,△H<0,高温下不能自发进行,故B错误;
C.△H-T△S>0,反应非自发进行,常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,已知反应△S>0,满足△H-T△S>0,则△H>0,故C正确;
D.△H<0且△S<0的反应,即△H-T△S<0,反应还受温度影响,所以不是在任何条件均可发生,故D错误;
故选C.
点评 本题考查了反应自发进行的判断依据,反应是否自发进行需要由反应的焓变、熵变、温度共同决定,题目难度不大,侧重于考查学生对基本原理的应用能力.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水 | B. | 配置500 mL 0.5 mol/L NaCl溶液 | ||
| C. | 除去CaCO3中混有的少量NaCl | D. | 分离食盐水和CCl4的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
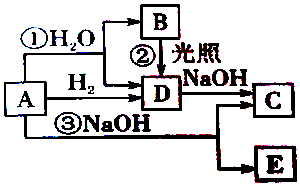
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol | B. | 0.15mol | C. | 0.2mol | D. | 0.215mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其阴阳离子个数比为1:2.
,其阴阳离子个数比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
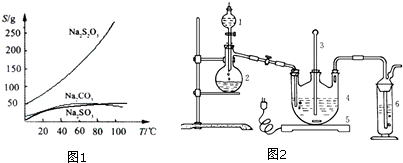
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
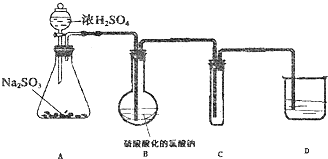
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与过量稀硝酸反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O | |
| B. | 将铜与硫单质混合加热:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com