
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
A. 图 表示温度对平衡的影响,且甲温度较高
表示温度对平衡的影响,且甲温度较高
B. 图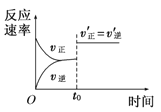 表示t0时刻恒容充入He(g)
表示t0时刻恒容充入He(g)
C. 图 表示t0时刻增大O2的浓度对反应速率的影响
表示t0时刻增大O2的浓度对反应速率的影响
D. 图 中a点v正 > v逆
中a点v正 > v逆
【答案】D
【解析】
容器的容积不变,2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,该反应是一个正反应方向气体物质的量减小且放热的反应,根据外界条件的改变对反应速率以及平衡移动的影响进行分析。
2SO3(g) ΔH<0,该反应是一个正反应方向气体物质的量减小且放热的反应,根据外界条件的改变对反应速率以及平衡移动的影响进行分析。
A. 乙到达平衡的时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO2的百分含量增大,A项错误;
B. t0时刻,恒容充入He(g),容器容积不变,各物质的浓度不变,因此正、逆反应速率都不变,B项错误;
C. t0时刻增大O2浓度的瞬间,反应物浓度增大,正反应速率瞬间增大,之后逐渐减小,生成物浓度此刻不变,逆反应速率不变,之后逐渐增大,C项错误;
D. 曲线上各点都是平衡点,a点时SO2的百分含量比相同温度下平衡时的百分含量大,因此应该向正反应方向进行,使SO2的百分含量减小达到平衡状态,则a点v正> v逆,D项正确;
答案选D。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________。
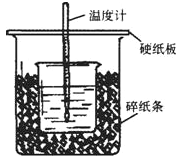
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________(填“相等”或“不相等”),所放出的热量________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______(填“偏大”、“偏小”或“无影响”).
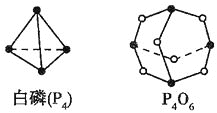
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能:![]() :
:![]() kJ·mol-1,
kJ·mol-1,![]() :
:![]() kJ·mol-1,
kJ·mol-1,![]() :
:![]() kJ·mol-1,则反应P4(白磷)+3O2=P4O6的热化学反应方程式为__________________。
kJ·mol-1,则反应P4(白磷)+3O2=P4O6的热化学反应方程式为__________________。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式___________________ 。
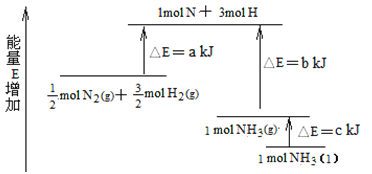
(7)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________。
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 0.6 molB. 2.8 molC. 1.4 molD. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
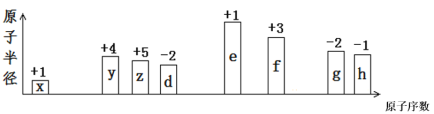
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________________。
(2)比较d、e常见离子的半径大小(用化学式表示)___________________;
(3)z的简单氢化物与z的最高价氧化物的水化物形成的化合物中化学键类型为:_______________________。
(4)元素y的一种同位素可用于测定文物年代,这种同位素原子符号为___________。
(5)元素g与元素h相比,非金属性较强的是_________(用元素符号表示),下列表述中能证明这一事实的是_________(填序号)。
a.常温下g的单质和h的单质状态不同
b.h的氢化物比g的氢化物稳定
c.一定条件下g和h的单质都能与氢氧化钠溶液反应
d.g、h最高价氧化物对应水化物的酸性前者弱于后者
(6)x、e反应可生成离子化合物ex。
①写出化合物ex的电子式__________________。
②将少量ex投入水中,剧烈反应,得到x单质。
写出反应的化学方程式:_____________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】培哚普利主要用于治疗高血压与充血性心力衰竭,其合成路线如下:
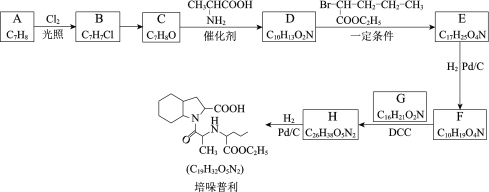
已知:ⅰ. ![]()
ⅱ.DCC是一种很强的脱水剂。
(1)芳香烃A的名称是___________________。
(2)B→C所需的试剂及条件是________________。
(3)C→D的化学方程式是____________________。
(4)D→E的反应类型是______________________。
(5)F的结构简式是____________________________。
(6)K存在互变异构体K′,G可由如下路线合成:
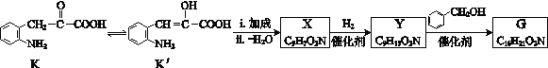
①X含有五元环和碳碳双键,其结构简式是______。
②上述合成培哚普利的路线中,将Y转化为G,再与F反应,而不直接用Y的主要目的是______,与合成路线中______________填字母)的转化目的相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05molL-1的某稀酸H2B溶液中滴入0.1molL-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
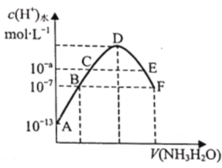
A.NaHB溶液中一定含有H2B分子
B.A、B、C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大
C.E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-)
D.B点溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 0.1mol氯气通入水中,转移电子的数目为0.1NA
B. 常温常压下,7.8g过氧化钠含有阴离子的数目为0.2NA
C. 标准状况下,22.4LCl2与足量的铁充分反应,转移电子数为3NA
D. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2 L的密闭容器内,充入0.2 mol CO与0.4 mol H2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
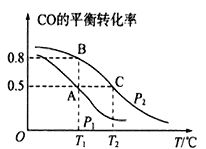
①A、B两点对应的压强大小关系是PA _______PB(填“>、<、=”)。
②在压强为P2时B、C两点的正反应速率大小关系是______________
③下列叙述能说明上述反应已达到化学平衡状态的是__________
A.H2的消耗速率是CH3OH生成速率的2倍 B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 D.CO和CH3OH的物质的量之比保持不变
(2)在压强为P1、温度为T1 ℃时,H2的平衡转化率为__________(计算出结果),再加入1.0 mol CO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)。
(3) 在压强为P1、温度为T1 ℃时,1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.05 mol、H2:0.1mol、CH3OH:0.05mol。此时v(正)________v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知醋酸的电离常数为1.75×10-5,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法正确的是(已知![]() =4.2)
=4.2)
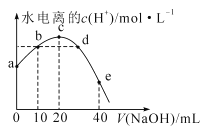
A.b、d两点溶液的pH相同
B.b点溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.e点所示溶液中,c(Na+)=2[c(CH3COO-)+c(CH3COOH)]=0.005mol/L
D.a点坐标为(0,2.4×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com