
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 0.1mol氯气通入水中,转移电子的数目为0.1NA
B. 常温常压下,7.8g过氧化钠含有阴离子的数目为0.2NA
C. 标准状况下,22.4LCl2与足量的铁充分反应,转移电子数为3NA
D. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() Cu(NO3)2
Cu(NO3)2
D.Cu ![]() CuCl2
CuCl2 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.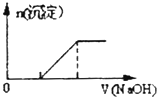
向O.1mo1﹣L﹣1该物质的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.CO2和H2O
B.CCl4和KCl
C.NaCl和HCl
D.SO2和SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B(固体B)两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:

请回答:
(1)A的原子结构示意图是_________________,B的化学式____________________。
(2)反应②中发生的反应离子方程式_________________________________________。
(3)沉淀H→沉淀I的化学方程式___________________________________________。
(4)溶液E→沉淀J的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________。
(2)在实验室中,FeCl2可用铁粉和______(填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
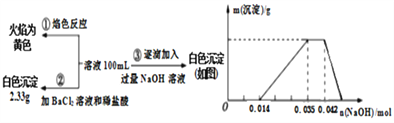
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是______________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________,所得沉淀的最大质量是____g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com