
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.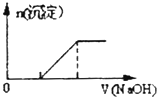
向O.1mo1﹣L﹣1该物质的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
【答案】C
【解析】A.[(NH4)2Fe(SO4)2中含有Fe2+,Fe2+可被Cl2氧化而不能大量共存,故A不符合题意;
B.滴加NaOH溶液,首先Fe2+先与OH﹣反应生成白色沉淀,图象错误,故B不符合题意;
C.滴入几滴KSCN溶液,若溶液变红色,说明Fe2+被氧化为Fe3+,故C符合题意;
D.恰好使S042﹣完全沉淀的离子方程式为:2NH4++Fe2++2SO42﹣+3Ba2++4OH﹣═2BaSO4↓+Fe(OH)2↓+2NH3↑+2H2O,故D不符合题意;
故答案为:C.
A.亚铁离子能被氯气氧化为铁离子;
B.亚铁离子与氢氧化钠反应生成白色氢氧化亚铁沉淀后铵根离子再反应;
C.根据三价铁离子的检验方法进行判断;
D.根据反应物的物质的量关系判断离子方程式正误.


科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:![]()
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净.可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺.精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S.(CuFeS2中S为﹣2价)则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,46g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式: FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3 . 高铁酸钾作为水处理剂发挥的作用是 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A. Na2O2和H2O B. Na和O2 C. Ca(OH)2和CO2 D. C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制的饱和氯水中含有多种做粒,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成。
(1)氯气能使湿润的红色布条褪色,使其褪色的微粒的化学式是__________。
(2)将氯水光照一段时间后,溶液颜色逐渐变浅,有关反应的化学方程式为__________、__________。
(3)新制的饱和氯水与碳酸钙的反应是制取较浓HClO 溶液 的 方 法 之一。
实验一 定性研究:

Ⅰ.如图所示,在试管中加入过量的块状碳酸钙,再加入约20 mL新制的饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去。
Ⅱ.过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强。
Ⅲ.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体,
将第三份加热,观察到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
①反应后所得的溶液漂白性增强的原因是__________________________________________________。
②依据上述实验可推知:步骤Ⅱ的滤液中的溶质除CaCl2、HClO外,还有__________。
实验二 定量研究:
在仪器A内,放有塑料网包住的块状碳酸钙(过量)和150 mL新制的饱和氯水,按如图所示装置实验(实验前仪器B中充满了饱和NaHCO3溶液),待不再产生气泡后,将塑料网中剩余的碳酸钙提出液面,密封后再加热烧瓶中的液体,直到仪器B中的气体不再增加(不考虑HClO的分解)。

③仪器A的名称为__________。
④准确读出仪器B中气体体积的实验操作步骤依次是:a.等待仪器A冷却到室温;b.____________;c. 平视与刻度线相切的液面读数。
⑤实验结束后,测得仪器B中收集到的气体体积在标准状况下为168mL,则150mL 新制的饱和氯水与过量碳酸钙完全反应后,所得溶液中HClO的物质的量浓度为__________。(反应前后,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酸、碱、盐的说法正确的是
A. 能电离出H+的化合物称为酸 B. 水溶液显碱性的化合物是碱
C. 盐中一定含有金属阳离子 D. 酸、碱、盐在一定条件下都能发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的4L密闭容器中,进行可逆反应:X(g)+2Y(g) ![]() 2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )
2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )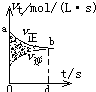
A.X的浓度的减少
B.Y物质的量的减少
C.Z的浓度的增加
D.X物质的量的减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.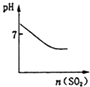
可表示将SO2气体通入溴水时pH的变化
B.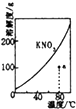
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C.
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.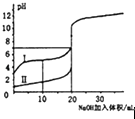
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 0.1mol氯气通入水中,转移电子的数目为0.1NA
B. 常温常压下,7.8g过氧化钠含有阴离子的数目为0.2NA
C. 标准状况下,22.4LCl2与足量的铁充分反应,转移电子数为3NA
D. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com