
【题目】某反应可表示为:mM+nH++O2===xM2++yH2O,则x值为 ( )
A. 2 B. 4 C. 6 D. 9
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.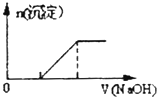
向O.1mo1﹣L﹣1该物质的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B(固体B)两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:

请回答:
(1)A的原子结构示意图是_________________,B的化学式____________________。
(2)反应②中发生的反应离子方程式_________________________________________。
(3)沉淀H→沉淀I的化学方程式___________________________________________。
(4)溶液E→沉淀J的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________。
(2)在实验室中,FeCl2可用铁粉和______(填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到氯丁橡胶和富马酸。
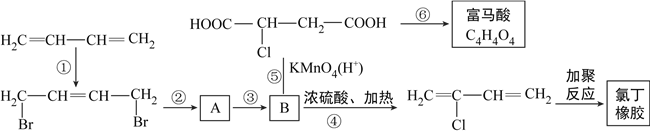
(1)B的名称为2-氯-1,4-丁二醇,请你写出B的结构简式____________________。
(2)请你写出第②步反应的化学方程式:______________________________。
(3)反应①~⑥中,属于消去反应的有______________________________。
(4)有机合成中的路线和步骤选择非常重要,若将第②步和第③步的顺序调换,则B结构将是____________________。
(5)如果没有设计③和⑥这两步,直接用KMnO4/H+处理物质A,导致的问题是:______________________________。
(6)某种有机物的分子式为C5H6O4,它的分子中所含官能团的种类、数目均与富马酸相同,不考虑顺反异构,它可能的结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
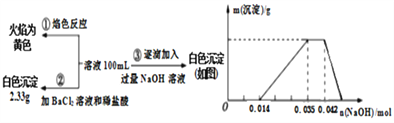
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是______________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________,所得沉淀的最大质量是____g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。实验室提取碘的途径如下所示:
![]()
(1)碘元素在海水中以________存在(填“游离态”或“化合态”)。
(2)灼烧过程中用到的实验仪器有铁三角架、酒精灯、______、_____、______。
(3)操作①中需用到玻璃棒,则玻璃棒的作用是_______________。
(4)向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________。
(5)操作③是分液,则操作②是___________;操作④是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com