
【题目】下列图示与对应的叙述相符的是( )
A.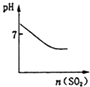
可表示将SO2气体通入溴水时pH的变化
B.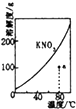
表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液
C.
表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.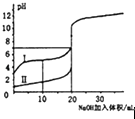
表示室温下,0.100mol/L NaOH溶液分别滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线
【答案】B
【解析】A、溴水显酸性,故起点时溶液的pH应小于7,故A不符合题意;
B、曲线上所有的点代表相应温度下KNO3溶液的溶解度,均为饱和溶液,a点溶解的KNO3的质量远小于饱和时的数值,因此a点所示的溶液是 80℃时 KNO3 的不饱和溶液,故B符合题意
C、醋酸溶液中不断加入氨水,生成醋酸铵为强电解质,导电性增强,当氨水过量时,继续加氨水溶液被稀释,导电性减弱,故C不符合题意;
D、盐酸为强酸、醋酸为弱酸,0.100mol/L的盐酸和醋酸的PH大的为醋酸,故图中I为醋酸,故D不符合题意;
所以答案是:B.
【考点精析】本题主要考查了溶解度、饱和溶液的概念和弱电解质在水溶液中的电离平衡的相关知识点,需要掌握在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度;当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
实验编号 | HA物质的量浓度(mol*L﹣1) | NaOH物质的量浓度(mol*L﹣1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况表明,HA是(填“强酸”或“弱酸”).
(2)②组情况表明,c0.2(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A﹣)与c(Na+)的大小关系是 .
(3)从③组实验结果分析,说明HA的电离程度NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是 .
(4)①组实验所得混合溶液中由水电离出的c(OH﹣)与溶液中的c(OH﹣)之比为 . 写出该混合溶液中下列算式的精确结果(不能近似计算):c(Na+)﹣c(A﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 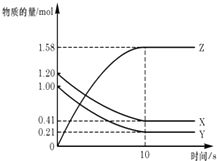
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存
B.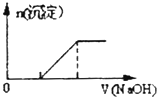
向O.1mo1﹣L﹣1该物质的溶液中清加0.Lmol﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
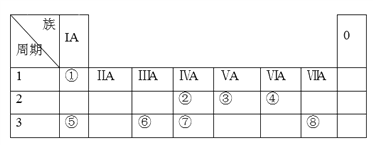
(1)①的元素符号为______;②的元素符号为______;③的元素符号为______;④的元素符号为______;⑤的元素符号为______;⑥的元素符号为______;⑦的元素符号为______;⑧的元素符号为_______。
(2)⑧的气态氢化物为_____________(填化学式)。
(3)⑤对应的碱的化学式为__________;③的最高价含氧酸为___________(填化学式)。
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B(固体B)两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:

请回答:
(1)A的原子结构示意图是_________________,B的化学式____________________。
(2)反应②中发生的反应离子方程式_________________________________________。
(3)沉淀H→沉淀I的化学方程式___________________________________________。
(4)溶液E→沉淀J的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com