
(10分)化合物F是一种调香剂,结构为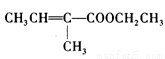 ;以化合物A为原料合成F的工艺流程如下:
;以化合物A为原料合成F的工艺流程如下:

根据上述信息回答下列问题:
(1)化合物F不能发生的反应类型有 (填序号)。
A.加成反应 B.醋化反应 C.水解反应 D.加聚反应
(2)化合物A的结构简式为 ;分子中不同化学环境的氢核磁共振谱峰面积比为
(3)反应④的化学方程式为
(4)化合物F反式异构体结构简式为
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如右图)。下列说法正确的是
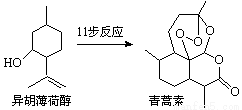
A.异胡薄荷醇的分子式为C10H17O
B.异胡薄荷醇在NaOH醇溶液中可发生消去反应
C.青蒿素分子中含有7个手性碳原子
D.青蒿素在热的酸、碱溶液中均可稳定存在
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是
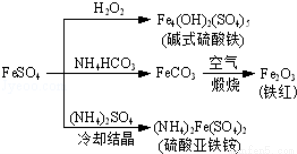
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:选择题
下表是在相同温度下三种酸的一些数据,下列判断正确的是
酸 | HX | HY | HZ | ||
浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.可通过酸性高锰酸钾溶液来区别乙烷和乙炔
B.乙烯是石油裂解后的产物
C.石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化
D.棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期10月月考化学试卷(解析版) 题型:选择题
用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:填空题
(1 0分)短周期元素A、B、C、D、E原子序数依次增大,其中A与B可形成A2B2和A2B两种化合物;C与A位于同一主族;D与B形成的化合物是大气污染物,容易形成酸雨。
请回答下列问题:
(1)由A、 B、E三种元素按原子个数比1:1:1组成的化合物的结构式为 。
(2)写出DB2使酸性KMn04溶液褪色的离子方程式
(3)电解100 mL 1mol.L-l的化合物CE的溶液时,若阴、阳极都用石墨作电极,电解一段时间,当阳极产生1 1.2 mL气体(标准状况),此时溶液的PH= (假设溶液体积不变).由上述五种元素中的三种元素组成,按原子个数比为1:1:1的强电解质x溶于水能抑制水的电离,则x的化学式为 。
(4)将化合物DB2通入化合物C2D的溶液中,充分反应后,溶液出现浑浊,则含1. 2n moi化合物C2D的溶液最多能吸收化合物DB2的物质的量为____ (不考虑水中溶解的化合物DB2)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上期中测试化学试卷(解析版) 题型:选择题
下列反应中必须加入还原剂才能实现的是
A.Fe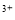 →Fe
→Fe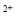 B.Zn→ Zn2+
B.Zn→ Zn2+
C.H 2→H2O D.CuO→CuCl2
查看答案和解析>>
科目:高中化学 来源:2016届福建省晨曦、冷曦、正曦、岐滨四校高三第二次联考理综化学试卷(解析版) 题型:实验题
(19分)晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)  SiHCl3(g)+H2(g) ΔH<0
SiHCl3(g)+H2(g) ΔH<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择_______(填序号字母),原因是_______________;
a .520~530K B.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
沸点/℃ | 57.7 | 33.0 | - | 315 |
升华温度/℃ | - | - | 180 | 300 |
(1)现用如下装置进行模拟反应②的过程。实验室制HCl的反应原理为:
2NaCl(s) + H2SO4(浓) 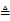 2HCl↑ + Na2SO4
2HCl↑ + Na2SO4
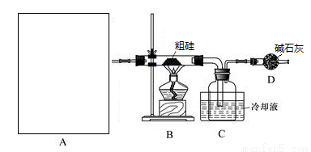
A中是HCl的发生装置,你认为应选择下列哪套装置?____________(填装置的序号字母),装置D中碱石灰的作用为__________________、___________________;
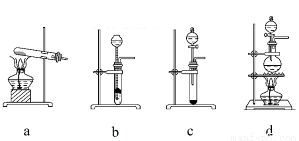
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为_____________(填操作名称),下列不是该操作所需的仪器是____________________(填装置序号字母);
a.冷凝管 b. 圆底烧瓶 c. 蒸馏烧瓶 d. 分液漏斗 e.温度计 f. 接受器
(3)用SiHCl3与H2反应制备纯硅的装置如下:
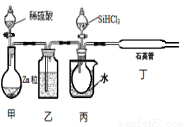
①按图示组装好仪器后,下列实验步骤的正确顺序为____________(填步骤的序号字母),
A.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
B.向装置中添加药品;
C.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
D.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为____________(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com