
| A. | 加水,振荡 | B. | 加Na0H溶液,煮沸 | C. | 加Na2SO4溶液 | D. | 直接观察 |
分析 植物油属于油脂,可水解,而矿物油为烃类混合物,利用与NaOH反应后的溶液可鉴别,以此来解答.
解答 解:A.植物油与矿物油都不溶于水,密度都比水小,分层油层在上层,现象相同,无法区别,故A不选;
B.植物油属于酯类,在碱性条件下能水解,混合物不分层,矿物油属于烃类,不水解,分层,现象不同,可区别,故B选;
C.植物油与矿物油都不溶于硫酸钠溶液且密度都小于硫酸钠溶液,分层时油层在上层,现象相同,无法区别,故C不选;
D.二者都是油状液体,直接观察,无法区别,故D不选;
故选B.
点评 本题考查物质的鉴别,为高频考点,把握有机物的结构与性质、性质差异为解答的关键,注意植物油为油脂,侧重分析与实验能力的考查,利用物质差异性选取合适的鉴别方法,题目难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| C. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
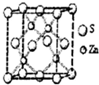 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱 | |
| B. | 已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强 | |
| C. | 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈 | |
| D. | 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com