
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
分析 A.两种离子电子层结构相同,则其核外电子总数相等,据此列式计算;
B.中子数=质量数-质子数,据此分别计算出该化合物中含有的电子总数、中子总数;
C.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断;
D.ⅥA族中,O的非金属性最强,且水中含氢键.
解答 解:A.若aXm+和bYn-两种离子电子层结构相同,则两种离子的核外电子总数相等,即:a-m=b+n,整理可得:a-b=m+n,故A错误;
B.24Mg32S中含有的电子总数为:12+16=28,含有的中子总数为:24-12+32-16=28,所以电子总数与中子总数之比为1:1,故B正确;
C.CO2中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子结构,氧元素化合价的绝对值是+2,氧原子最外层电子数是6,2+6=8,所以氧原子满足8电子结构;PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构,根据分析可知,CO2和PC13分子中各原子最外层都满足8电子结构,故C正确;
D.ⅥA族中,O的非金属性最强,且水中含氢键,则ⅥA族元素的氢化物中稳定性最好的,其沸点也最高,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,把握元素在周期表中的位置、性质即可解答,注意掌握原子的电子数、质子数、中子数之间的关系,试题培养了学生的分析能力及灵活应用能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有NO2和Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为  | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
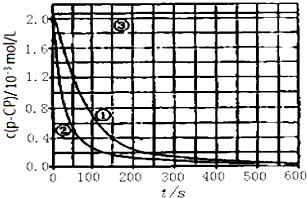
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
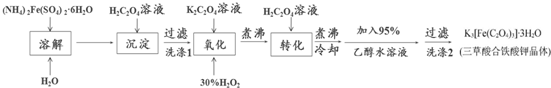
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com