
【题目】向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是
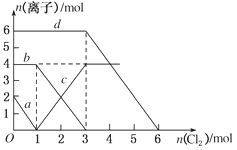
A.d曲线代表溶液中Br-变化情况
B.原溶液中FeI2的物质的量为2 mol
C.原溶液中n(Fe2+):n(Br-)=2:3
D.当通入2 mol Cl2时,溶液中离子反应为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
【答案】B
【解析】
试题分析:A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,则通入氯气,先与碘离子反应,再与Fe2+反应,a对应氯气与碘离子的反应,c对应氯气与亚铁离子反应,当加3mol氯气时溴离子开始反应,则d曲线代表溶液中Br-变化情况,A正确;B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,FeI2的物质的量为1mol,B错误;C、由B可知,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(Br-)=2:3,C正确;D、当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,D正确。


科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ![]() 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2mol C B. 2mol A、3mol B和1mol He(He不参加反应)
C. 1mol B和1mol C D. 2mol A、3mol B和3mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是

A. X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐
B. 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z
C. Z的单质常温下是液体,可与铁粉反应
D. Z的原子序数比Y大9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制480 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量锌粉与一定量稀盐酸反应,为了减慢反应速率,但又不影响生成的氢气总量,可采取的措施是
A. 升高温度 B. 加入浓度较大的盐酸 C. 加入少量CuSO4 D. 加入适量的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)一定条件下的密闭容器中,进行反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
A.NO的生成速率与NO的消耗速率相等 B.υ(CO)=υ(CO2)
C.体系的压强保持不变 D.各物质的浓度保持不变
(2)可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:C(s)+2NO(g)![]() N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L﹣1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
①写出该反应的平衡常数表达式:K=____________________。
②30min后,改变某一条件,平衡发生了移动,则改变的条件是_______________;若升高温度,NO浓度将_______(填“增大”、“不变”或“减小”)。
③计算从0~20min内,NO的平均反应速率为___________________。
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用试纸检验气体是一种重要的实验方法.下列试纸的选用以及对应的现象、结论都正确的一项是
A. 用干燥的pH试纸检验CO2
B. SO2能使湿润的品红试纸褪色
C. 用干燥的红色石蕊试纸检验NH3
D. 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题. 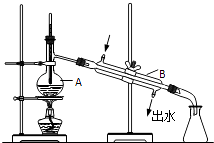
(1)图中的两处明显的错误是
(2)A仪器的名称是 , B仪器的名称是
(3)实验时A中除加入自来水外,还需加入少量 , 其作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com