
ЁОЬтФПЁПШчЭМЫљЪОЃЌШ§ИіЩеЦПжаЗжБ№ГфТњNO2ЦјЬхВЂЗжБ№ЗХжУдкЪЂгаЯТСаЮяжЪЕФЩеБ(ЩеБФкгаЫЎ)жаЃКдк(1)жаМгШыCaOЃЌдк(2)жаВЛМгЦфЫћШЮКЮЮяжЪЃЌдк(3)жаМгШыNH4ClОЇЬхЃЌЗЂЯж(1)жаКьзиЩЋБфЩюЃЌ(3)жаКьзиЩЋБфЧГЁЃ[вбжЊЗДгІ2NO2(КьзиЩЋ) N2O4(ЮоЩЋ)]
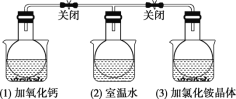
ЯТСаа№Ъіе§ШЗЕФЪЧ(ЁЁЁЁ)
A.2NO2N2O4ЪЧЗХШШЗДгІ
B.NH4ClШмгкЫЎЪБЗХГіШШСП
C.ЩеЦП(1)жаЦНКтЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПдіДѓ
D.ЩеЦП(3)жаЦјЬхЕФбЙЧПдіДѓ
ЁОД№АИЁПA
ЁОНтЮіЁП
2NO2(g)N2O4(g)ЃЌNO2ЮЊКьзиЩЋЦјЬхЃЌN2O4ЮЊЮоЩЋЦјЬхЃЌШєКьзиЩЋМгЩюЃЌЫЕУїЯђЩњГЩNO2ЕФЗНЯђНјааЃЌШєКьзиЩЋБфЧГЫЕУїЯђЩњГЩN2O4ЕФЗНЯђНјааЃЛвбжЊCaOКЭЫЎЗДгІЩњГЩЧтбѕЛЏИЦЕФЗДгІЪЧЗХШШЗДгІЃЌОнДЫЗжЮіЃЈ1ЃЉЦПжаЕФШШСПБфЛЏЃЛЃЈ3ЃЉЦПжабеЩЋБфЧГЃЌЫЕУїЗДгІе§ЯђвЦЖЏЃЌИљОнЗНГЬЪНЗЂЯжЗДгІКѓЦјЬхЬхЛ§БфаЁЃЌОнДЫЗжЮіЃЈ3ЃЉЦПЕФбЙЧПБфЛЏЧщПіЁЃ
A.ЃЈ1ЃЉжаКьзиЩЋБфЩюЃЌЫЕУїЦНКтЪЧЯђФцЗДгІЗНЯђвЦЖЏЕФЃЌЖјCaOКЭЫЎЗДгІЗХГіШШСПЃЌМДФцЗДгІЗНЯђЪЧЮќШШЗДгІЃЌдђе§ЗДгІЗНЯђЪЧЗХШШЗДгІЃЌЙЪAе§ШЗЃЛ
B.ЃЈ3ЃЉжаКьзиЩЋБфЧГЃЌЫЕУїЦНКте§ЯђвЦЖЏЃЌе§ЗДгІЪЧЗХШШЗДгІЃЌдђТШЛЏяЇШмгкЫЎЪБЮќЪеШШСПЃЌЙЪBДэЮѓЃЛ
C.ЃЈ1ЃЉжаЦНКтФцЯђвЦЖЏЃЌNO2КЭжЎЧАЯрБШКЌСПдіЖрЃЌдђЬхЯЕжаЦНОљЯрЖдЗжзгжЪСПМѕаЁЃЌЙЪCДэЮѓЃЛ
D.ЃЈ3ЃЉжаКьзиЩЋБфЧГЃЌЫЕУїТШЛЏяЇШмгкЫЎЪБЮќЪеШШСПЃЌЦНКте§ЯђвЦЖЏЃЌЦјЬхЕФЮяжЪЕФСПМѕаЁЃЌдђЩеЦПЃЈ3ЃЉжаЕФбЙЧПБиШЛМѕаЁЃЌЙЪDДэЮѓЃЛ
Д№АИбЁAЁЃ


 ПкЫуФмЪжЯЕСаД№АИ
ПкЫуФмЪжЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
A. НЋЯЁАБЫЎж№ЕЮМгШыЯЁСђЫсжаЃЌЕБШмвКpH=7ЪБЃЌc(SO42-)ЃОc(NH4+)
B. СНжжДзЫсШмвКЕФЮяжЪЕФСПХЈЖШЗжБ№ЮЊc1КЭc2ЃЌpHЗжБ№ЮЊaКЭa+1ЃЌдђc1=10c2
C. pH=11ЕФNaOHШмвКгыpH=3ЕФДзЫсШмвКЕШЬхЛ§ЛьКЯЃЌЕЮШыЪЏШяШмвКГЪКьЩЋ
D. Яђ0.1 mol/LЕФАБЫЎжаМгШыЩйСПСђЫсяЇЙЬЬхЃЌдђШмвКжа діДѓ
діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђМАЦфЛЏКЯЮягааэЖргУЭОЁЃЯрЙиЮяжЪЕФЮяРэГЃЪ§ШчБэЫљЪОЃК
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
ШлЕу/Ёц | -85.5 | 115.2 | ЃО600(ЗжНт) | -75.5 | 16.8 | 10.3 |
ЗаЕу/Ёц | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЛљЬЌFeдзгМлВуЕчзгЕФЕчзгХХВМЭМЃЈЙьЕРБэДяЪНЃЉЮЊ____________ЃЌЛљЬЌSдзгЕчзгеМОнзюИпФмМЖЕФЕчзгдЦТжРЊЭМЮЊ____________аЮЁЃ
ЃЈ2ЃЉИљОнМлВуЕчзгЖдЛЅГтРэТлЃЌH2SЃЌSO2ЃЌSO3ЕФЦјЬЌЗжзгжаЃЌжааФдзгМлВуЕчзгЖдЪ§ВЛЭЌгкЦфЫћЗжзгЕФЪЧ____________ЁЃ
ЃЈ3ЃЉЭМЃЈaЃЉЮЊS2ЕФНсЙЙЃЌЦфШлЕуКЭЗаЕувЊБШЖўбѕЛЏСђЕФШлЕуКЭЗаЕуИпКмЖрЃЌжївЊдвђЮЊ____________ЁЃ
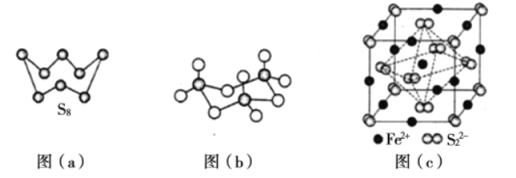
ЃЈ4ЃЉЦјЬЌШ§бѕЛЏСђвдЕЅЗжзгаЮЪНДцдкЃЌЦфЗжзгЕФСЂЬхЙЙаЭЮЊ____________аЮЃЌЦфжаЙВМлМќЕФРраЭга____________жжЃЛЙЬЬхШ§бѕЛЏСђжаДцдкШчЭМЃЈbЃЉЫљЪОЕФШ§ОлЗжзгЁЃИУЗжзгжаSдзгЕФдгЛЏЙьЕРРраЭЮЊ____________ЁЃ
ЃЈ5ЃЉ FeS2ОЇЬхЕФОЇАћШчЭМЃЈcЃЉЫљЪОЃЌОЇАћБпГЄЮЊa nmЃЌ FeS2ЯрЖдЪНСПЮЊMЁЂАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNAЃЌЦфОЇЬхУмЖШЕФМЦЫуБэДяЪНЮЊ____________gЁЄcmЃ3ЃЛОЇАћжаFe2+ЮЛгкS22ЃЫљаЮГЩЕФАЫУцЬхЕФЬхаФЃЌИУе§АЫУцЬхЕФБпГЄЮЊ____________nmЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЭљЖўдЊШѕЫсЕФФЦбЮNa2AШмвКжаЭЈШыHClЃЌШмвКжа-lg![]() КЭ-lgc(A2-)ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
КЭ-lgc(A2-)ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
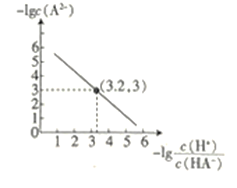
A.K(HA-)ЕФЪ§СПМЖЮЊ10-7
B.ЭЈШыHClЕФЙ§ГЬжаЃЌЫЎЕчРыГіЕФc(H+)ВЛЖЯдіДѓ
C.дкNa2AШмвКжаЃКc(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.ЕБЭЈШыЕФHClЕФЮяжЪЕФСПгыNa2AЕФЮяжЪЕФСПЯрЕШЪБc(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжаЕФвЛЖЈСПAЁЂBЛьКЯЦјЬхЗЂЩњЗДгІЃКaAЃЈgЃЉ+bB(g)![]() cC(g)ЁЃЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.5mol/LЃЛБЃГжЮТЖШВЛБфЃЌНЋШнЦїЕФШнЛ§РЉДѓЕНдРДЕФСНБЖЃЌдйДЮДяЕНЦНКтЪБЃЌВтЕУAЕФХЈЖШЮЊ0.28mol/LЁЃЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
cC(g)ЁЃЦНКтЪБВтЕУAЕФХЈЖШЮЊ0.5mol/LЃЛБЃГжЮТЖШВЛБфЃЌНЋШнЦїЕФШнЛ§РЉДѓЕНдРДЕФСНБЖЃЌдйДЮДяЕНЦНКтЪБЃЌВтЕУAЕФХЈЖШЮЊ0.28mol/LЁЃЯТСагаЙиХаЖЯе§ШЗЕФЪЧ
A. a+b=cB. ИУБфЛЏЪЙЦНКте§ЯђвЦЖЏ
C. BЕФзЊЛЏТЪНЕЕЭD. CЕФЬхЛ§ЗжЪ§діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБНМзѕЃТШ(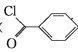 )ЪЧжЦБИШОСЯЃЌЯуСЯвЉЦЗКЭЪїжЌЕФживЊжаМфЬхЃЌвдЙтЦјЗЈжЦБИБНМзѕЃТШЕФдРэШчЯТ(ИУЗДгІЮЊЗХШШЗДгІ)ЃК
)ЪЧжЦБИШОСЯЃЌЯуСЯвЉЦЗКЭЪїжЌЕФживЊжаМфЬхЃЌвдЙтЦјЗЈжЦБИБНМзѕЃТШЕФдРэШчЯТ(ИУЗДгІЮЊЗХШШЗДгІ)ЃК
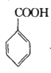 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
вбжЊЮяжЪаджЪШчЯТБэЃК
ЮяжЪ | ШлЕу/Ёц | ЗаЕу/Ёц | ШмНтад |
БНМзЫс | 122.1 | 249 | ЮЂШмгкЫЎЃЌвзШмгкввДМЁЂввУбЕШгаЛњШмМС |
ЬМѕЃТШ(COCl2) | -188 | 8.2 | НЯвзШмгкБНЁЂМзБНЕШЁЃгіЫЎбИЫйЫЎНтЃЌЩњГЩТШЛЏЧтЃЌгыАБКмПьЗДгІЃЌжївЊЩњГЩФђЫи[CO(NH2)2]КЭТШЛЏяЇЕШЮоЖОЮяжЪ |
БНМзѕЃТШ | -1 | 197 | ШмгкввУбЁЂТШЗТКЭБНЁЃгіЫЎЛђввДМж№НЅЗжНтЃЌЩњГЩБНМзЫсЛђБНМзЫсввѕЅКЭТШЛЏЧт |
Ш§ТШМзЭщ(CHCl3) | -63.5 | 63.1 | ВЛШмгкЫЎЃЌШмгкДМЁЂБНЁЃМЋвзЛгЗЂЃЌЮШЖЈадВюЃЌ450ЁцвдЩЯЗЂЩњШШЗжНт |
I.жЦБИЬМѕЃТШ
ЗДгІдРэЃК2 CHCl3ЃЋO2![]() 2HClЃЋCOCl2
2HClЃЋCOCl2
Мз. 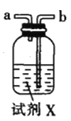 вв.
вв. 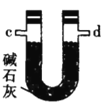 Бћ.
Бћ. 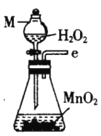 ЖЁ.
ЖЁ. Юь.
Юь. 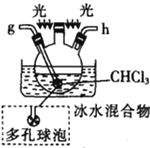
(1)вЧЦїMЕФУћГЦЪЧ____________
(2)АДЦјСїгЩзѓжСгвЕФЫГађЮЊ___________ЁњcЁњdЁњ_________Ёњ_________Ёњ_________Ёњ_________Ёњ_________.
(3)ЪдМСXЪЧ_______________(ЬюУћГЦ)ЁЃ
(4)зАжУввжаМюЪЏЛвЕФзїгУЪЧ____________ЁЃ
(5)зАжУЮьжаБљЫЎЛьКЯЮяЕФзїгУЪЧ____________ЃЛЖрПзЧђХнЕФзїгУЪЧ________________ЁЃ
Ђђ.жЦБИБНМзѕЃТШ(ВПЗжМаГжзАжУЪЁТд)
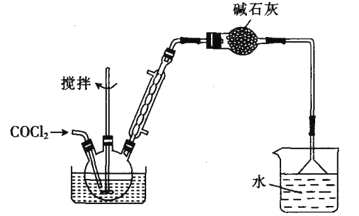
(6)ЬМѕЃТШвВПЩвдгУХЈАБЫЎЮќЪеЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃК______________ЁЃ
ШєЯђШ§ОБЩеЦПжаМгШы610gБНМзЫсЃЌЯШМгШШжС140~150ЁцЃЌдйЭЈШыCOCl2ЃЌГфЗжЗДгІКѓЃЌзюКѓВњЦЗОМѕбЙеєСѓЕУЕН562gБНМзѕЃТШЃЌдђБНМзЫсЕФзЊЛЏТЪЮЊ_________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЮЭтаЁзщЗжБ№гУШчЭМЫљЪОзАжУЖддЕчГиКЭЕчНтдРэНјааЪЕбщЬНОПЁЃ
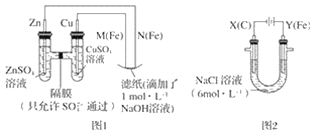
ЧыЛиД№ЃК
ЂёЃЎгУЭМ 1 ЫљЪОзАжУНјааЕквЛзщЪЕбщЁЃ
ЃЈ1ЃЉдкБЃжЄЕчМЋЗДгІВЛБфЕФЧщПіЯТЃЌВЛФмЬцДњ Cu зїЕчМЋЕФЪЧ__ЃЈЬюзжФИађКХЃЉЁЃ
A ТС B ЪЏФЋ C вј D ВЌ
ЃЈ2ЃЉN МЋЗЂЩњЗДгІЕФЕчМЋЗДгІЪНЮЊ__ЁЃ
ЂђЃЎгУЭМ 2 ЫљЪОзАжУНјааЕкЖўзщЪЕбщЁЃЪЕбщЙ§ГЬжаЃЌЙлВьЕНгыЕквЛзщЪЕбщВЛЭЌЕФЯжЯѓЃКСНМЋОљгаЦјЬхВњЩњЃЌYМЋЧјШмвКж№НЅБфГЩзЯКьЩЋЃЛЭЃжЙЪЕбщЃЌЬњЕчМЋУїЯдБфЯИЃЌЕчНтвКШдШЛГЮЧхЁЃ ВщдФзЪСЯЕУжЊЃЌИпЬњЫсИљРызгЃЈFeO42-ЃЉдкШмвКжаГЪзЯКьЩЋЁЃ
ЃЈ3ЃЉЕчНтЙ§ГЬжаЃЌX МЋЧјШмвКЕФ pH__ЃЈЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ4ЃЉЕчНтЙ§ГЬжаЃЌY МЋЗЂЩњЕФЕчМЋЗДгІжЎвЛЮЊ FeЉ6eЉ+8OHЉ= FeO42-+4H2O Шєдк X МЋЪеМЏЕН672 mL ЦјЬхЃЌдк Y МЋЪеМЏЕН 168 mL ЦјЬхЃЈОљвбелЫуЮЊБъзМзДПіЪБЦјЬхЬхЛ§ЃЉЃЌдђ Y ЕчМЋЃЈЬњЕчМЋЃЉжЪСПМѕЩй____gЁЃ
ЃЈ5ЃЉдкМюадаПЕчГижаЃЌгУИпЬњЫсМизїЮЊе§МЋВФСЯЃЌЕчГиЗДгІЮЊ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2ЃЌИУЕчГие§МЋЗЂЩњЕФЗДгІЕФЕчМЋЗДгІЪНЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЩФцЗДгІЃК![]() дкКуШнШнЦїжаНјааЃЌДяЕНЦНКтзДЬЌЕФБъжОЪЧ( )
дкКуШнШнЦїжаНјааЃЌДяЕНЦНКтзДЬЌЕФБъжОЪЧ( )
ЂйЕЅЮЛЪБМфФкЩњГЩ![]() ЕФЭЌЪБЩњГЩ
ЕФЭЌЪБЩњГЩ![]()
ЂкЕЅЮЛЪБМфФкЩњГЩ![]() ЕФЭЌЪБЩњГЩ
ЕФЭЌЪБЩњГЩ![]()
ЂлгУ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕФЮяжЪЕФСПХЈЖШБфЛЏБэЪОЕФЗДгІЫйТЪжЎБШЮЊ2ЁУ2ЁУ1ЕФзДЬЌ
ЕФЮяжЪЕФСПХЈЖШБфЛЏБэЪОЕФЗДгІЫйТЪжЎБШЮЊ2ЁУ2ЁУ1ЕФзДЬЌ
ЂмЛьКЯЦјЬхЕФбеЩЋВЛдйИФБфЕФзДЬЌ
ЂнЛьКЯЦјЬхЕФУмЖШВЛдйИФБфЕФзДЬЌ
ЂоЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБфЕФзДЬЌ
A.ЂйЂмЂоB.ЂкЂлЂнC.ЂйЂлЂмD.ЂйЂкЂлЂмЂнЂо
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋ![]() зЊБфЮЊ
зЊБфЮЊ![]() ЕФЗНЗЈЮЊЃЈЁЁЁЁЃЉ
ЕФЗНЗЈЮЊЃЈЁЁЁЁЃЉ
A.гызуСПЕФNaOHШмвКЙВШШКѓЃЌдйЭЈШыCO2
B.ШмвКМгШШЃЌЭЈШызуСПЕФHCl
C.гыЯЁH2SO4ЙВШШКѓЃЌМгШызуСПЕФNa2CO3
D.гыЯЁH2SO4ЙВШШКѓЃЌМгШызуСПЕФNaOH
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com