
【题目】25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg![]() 和-lgc(A2-)的关系如图所示。下列说法正确的是( )
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
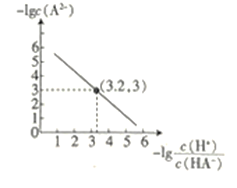
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
【答案】A
【解析】
起初往Na2A溶液中通入HCl,c(A2-)最大,其-lgc(A2-)最小,所以图象应从右往左看。
A.K(HA-)=![]() =10-3×10-3.2=10-6.2,则其数量级为10-7,A正确;
=10-3×10-3.2=10-6.2,则其数量级为10-7,A正确;
B.通入HCl的过程中,溶液中的c(A2-)不断减小,水解能力不断减弱,则水电离出的c(H+)不断减小,B不正确;
C.在Na2A溶液中:A2-+H2O![]() HA-+OH-,HA-+H2O
HA-+OH-,HA-+H2O![]() H2A+OH-,H2O
H2A+OH-,H2O![]() H++OH-,所以c(OH-)=2c(H2A)+ c(HA-)+ c(H+),C不正确;
H++OH-,所以c(OH-)=2c(H2A)+ c(HA-)+ c(H+),C不正确;
D.当通入的HCl的物质的量与Na2A的物质的量相等时,依据电荷守恒,c(Na+)+ c(H+)= c(HA-)+2c(A2-)+ c(OH-)+ c(Cl-),D不正确;
故选A。


科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×![]()
![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.将1 mol ![]() 转化为
转化为![]() 胶体,
胶体,![]() 胶粒数小于6.02×
胶粒数小于6.02×![]()
B.标准状况下,22.4 L![]() 中含有溴原子数约为2×6.02×
中含有溴原子数约为2×6.02×![]()
C.常温下,9.2 g ![]() 含有的分子数小于0.2×6.02×
含有的分子数小于0.2×6.02×![]()
D.25℃时,pH=12的![]() 溶液1 L所含
溶液1 L所含![]() 数约为6.02×
数约为6.02×![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1)Cu+基态核外电子排布式为___________。
(2)Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3)SO2分子中S原子的轨道杂化类型为________,分子的立体构型为________。
(4)[Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5)Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为_________。
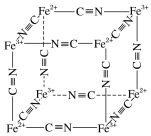
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )
世界最大射电望远镜“中国天眼” |
“嫦娥四号”月球探测器 |
中国大飞机C919 |
中国第一艘深海载人潜水器“蛟龙号” |
A.光导纤维传输线 | B.晶体硅芯片 | C.新型铝锂合金机翼 | D.氮化硅陶瓷发动机 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
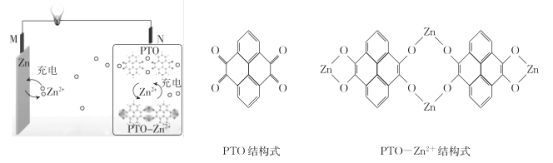
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为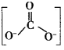 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
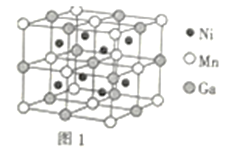
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
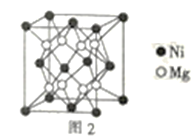
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) N2O4(无色)]
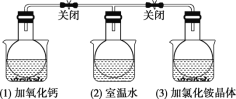
下列叙述正确的是( )
A.2NO2N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是人类较早发现和使用的一种重金属,工业上用铅精矿(主要成分含PbS)为原料,分火法和湿法两种方法冶炼。
Ⅰ.火法冶炼粗铅的流程如下:

(1)焙烧炉中主要反应的化学方程式为______________________。
(2)鼓风炉中焦炭的作用是___________,吸收塔中反应的离子方程式为___________。
Ⅱ.湿法炼铅的工艺流程如下:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在含Cl-的溶液中存在平衡:
PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)浸取过程中发生反应的离子方程式为______________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,其合理的解释为___________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。则阴极室中的电极反应式为___________;若该电解装置的外接电源为铅蓄电池,每生成20.7g铅,铅蓄电池中消耗硫酸的物质的量为___________。

(6)目前炼铅工艺以火法为主,但湿法炼铅也有其明显的优点,其优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示:
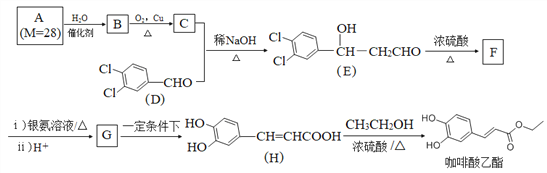
回答下列问题:
(1)C+D→E反应类型为______。F中含氧官能团的名称是______。
(2)D分子中位于同一平面上的原子最多有______个。G的结构简式为______。
(3)H→咖啡酸乙酯的化学方程式为______。
(4)芳香族化合物M是H的同分异构体,1 molM与足量碳酸氢钠溶液反应生成2 molCO2,M的结构有______种;其中核磁共振氢谱为5组峰,峰面积比为1∶2∶2∶2∶1的结构简式为______。
(5)以上图中的C和甲醛为原料,设计合成C5H12O4(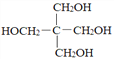 )的路线(无机试剂任任选)。________________________
)的路线(无机试剂任任选)。________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com