
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
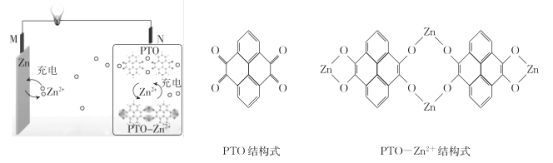
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
【答案】D
【解析】
放电时,金属Zn发生失电子的氧化反应生成Zn2+,即M电极为负极,则N电极为正极,电极反应式为2PTO+8e-+4Zn2+═PTO-Zn2+;充电时,外加电源的正极连接原电池的正极N,外加电源的负极连接原电池的负极。
A. 该原电池中,放电时M电极为负极,N电极为正极,正极得电子发生还原反应,故A正确;
B. 充电时,原电池的负极M连接外加电源的负极作阴极,电解质中阳离子Zn2+移向阴极M,故B正确;
C. 放电时,正极反应式为2PTO+8e-+4Zn2+═PTO-Zn2+,负极反应式为Zn-2e-=Zn2+,电子守恒有4Zn~PTO-Zn2+,所以每生成1molPTO-Zn2+,M极溶解Zn的质量=65g/mol×4mol=260g,故C正确;
D. 充电时,原电池的正极N连接外加电源的正极作阳极,发生失电子的氧化反应,电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+,故D错误;
故选:D。


科目:高中化学 来源: 题型:
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0,一段时间后达到平衡。下列说法不正确的是
2HI(g)△H<0,一段时间后达到平衡。下列说法不正确的是
A.保持容器体积不变,继续向其中加入1mol H2,平衡正向移动
B.保持容器体积不变,继续向其中加入1mol N2(N2不参加反应),化学反应速率不变
C.保持容器压强不变,继续向其中加入2mol HI,H2的体积分数不变
D.提高起始反应温度,正反应速率减慢,逆反应速率加快,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
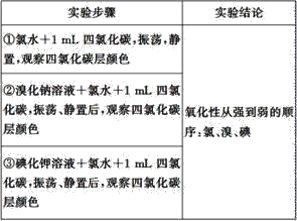
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物中,其一氯代物的数目不相等的是( )
A.正戊烷 和 正己烷B.新戊烷 和 2-甲基丙烷
C.2,2,3,3-四甲基丁烷 和 乙烷D.丙烷 和 2,3-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+ 6KOH== KIO3 +5KI+ 3H2O
反应II:3H2S+KIO3=3S↓+KI+ 3H2O
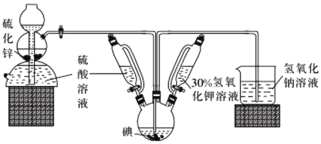
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为________。装置中盛装30%氢氧化钾溶液的仪器名称是__________。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为______(填现象),停止滴人KOH溶液;然后________(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是_______________。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和____(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)实验室模拟工业制备KIO3流程如下:
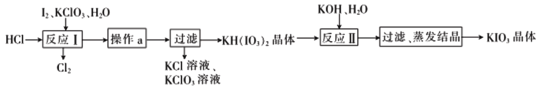
几种物质的溶解度见下表:
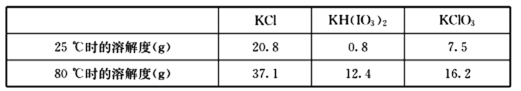
用惰性电极电解KI溶液也能制备KIO3,与电解法相比,上述流程制备KIO3的缺点是_________。
(6)某同学测定.上述流程生产的KIO3样品的纯度。
取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol·L-1 Na2S2O3溶液,恰好完全反应时共消耗12. 60 mL Na2S2O3溶液。该样品中KIO3的质量分数为___________(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好,以煤为原杵在不同条件下可合成下列物质(部分条件未标出),C是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
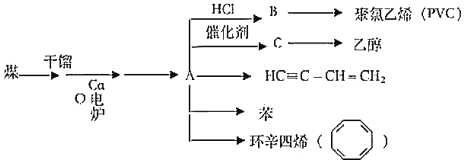
(1)写出A的电子式_____;C的空间构型为平面结构,键角约为_____。
(2)写出乙醇在Cu催化下与O2反应时的方程式_____。
(3)B中所含官能团的名称是_____。
(4)若分别完全燃烧等质量的HC=C—CH=CH2和乙炔,所需氧气的量_____(选填“前者多”“后者多”“一样多”)。
(5)苯乙烯(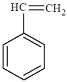 )与环辛四烯互为同分异构体,写出由苯乙烯合成聚苯乙烯的化学方程式_____。
)与环辛四烯互为同分异构体,写出由苯乙烯合成聚苯乙烯的化学方程式_____。
(6)异丙苯(![]() )是苯的同系物。由苯与2—丙醇反应制备异丙苯属于_____反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为_____。
)是苯的同系物。由苯与2—丙醇反应制备异丙苯属于_____反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为_____。
(7)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com