
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
【答案】2K+Cl2![]() 2KCl K+O2
2KCl K+O2![]() KO2 2K+2H2O
KO2 2K+2H2O![]() 2KOH+H2↑ 化合态 观察法、分类法、比较法、实验法 预测钾的物理性质和化学性质、利用实验来验证预测、作出正确分析和判断
2KOH+H2↑ 化合态 观察法、分类法、比较法、实验法 预测钾的物理性质和化学性质、利用实验来验证预测、作出正确分析和判断
【解析】
钠与钾都是活泼金属,它们都能与氯气化合生成金属氯化物;都能与水剧烈反应生成强碱和氢气;在空气中都极易被氧化生成氧化物(氧化钠与氧化钾);燃烧时钠生成过氧化钠(Na2O2),钾生成超氧化钾(KO2);它们在自然界中都以化合态的形式存在。
①钾在氯气中燃烧,与钠类似,应生成氯化钾;
②点燃钾剧烈燃烧,由题给信息,应生成超氧化钾;
③将小块钾投入冷水中,与钠反应产物类似,但比钠剧烈;
(2)由钠在自然界中只能以化合态形式存在,可类推出钾在自然界中的存在方式。
(3)该小组研究钾的性质时用到的主要方法有:与钠对比,进行类推分析,观察、实验等。
(4)他们研究金属钾性质的程序是先预测,然后实验证实,分析得出结论。
钠与钾都是活泼金属,它们都能与氯气化合生成金属氯化物;都能与水剧烈反应生成强碱和氢气;在空气中都极易被氧化生成氧化物(氧化钠与氧化钾);燃烧时钠生成过氧化钠(Na2O2),钾生成超氧化钾(KO2);它们在自然界中都以化合态的形式存在。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧,方程式为2K+Cl2![]() 2KCl;答案为:2K+Cl2
2KCl;答案为:2K+Cl2![]() 2KCl;
2KCl;
②点燃钾剧烈燃烧,方程式为K+O2![]() KO2;答案为:K+O2
KO2;答案为:K+O2![]() KO2;
KO2;
③将小块钾投入冷水中,方程式为2K+2H2O![]() 2KOH+H2↑;答案为:2K+2H2O
2KOH+H2↑;答案为:2K+2H2O![]() 2KOH+H2↑;
2KOH+H2↑;
(2)用钠进行类推,可得出钾在自然界中的存在方式是化合态。答案为:化合态;
(3)该小组研究钾的性质时用到的主要方法有观察法、分类法、比较法、实验法。答案为:观察法、分类法、比较法、实验法;
(4)他们研究金属钾性质的程序是:预测钾的物理性质和化学性质、利用实验来验证预测、作出正确分析和判断。答案为:预测钾的物理性质和化学性质、利用实验来验证预测、作出正确分析和判断。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】为应对石油短缺,一碳化学研究备受关注。一碳化学是指以分子中只含一个碳原子的化合物如甲醇、一氧化碳等为原料,制造产品的化学体系的总称。
(1)CH3OH(g)和NH3(g)在一定条件下反应可制得甲胺CH3NH2(g)。
![]()
![]()
①已知该反应中相关的化学键键能数据如下:
共价键 | C—O | N—H | C—N | C—H |
E/(kJ/mol) | a | b | c | d |
则H—O键的键能为_________________kJ/mol(用含有字母的代数式表示)
②在某恒容密闭容器中进行该反应,其他条件不变的情况下,分别测得起始时CH3OH(g)的物质的量和温度对平衡时CH3NH2(g)的体积分数的影响,如图所示:(图中T1、T2表示温度)

则T1_________T2(填“>”、“<”或“=”);____________(填“a”、“b”或“c”)点对应的平衡状态中反应物NH3(g)的转化率最大。b、d两点的平衡常数大小关系为Kb________Kd(填“>”、“<”或“=”)。
(2)甲醇在工业上可利用水煤气来合成:![]() 。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数
。将1mol CO和2mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

图中Y轴表示的外界条件为________________,判断的理由是______________________。
已知v(正)=k(正)·p(CO)·p(H2)2,v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应在20分钟达到平衡时![]() (CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时
(CH3OH)=10%,该温度下反应的平常数KP=____________kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时![]() ,此时
,此时![]() ______________(计算结果保留两位小数)
______________(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常常需要用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。用Na2C2O4固体测定KMnO4溶液浓度的实验步骤如下:(反应原理为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O)
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三:重复步骤二两到三次。计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)盛放KMnO4溶液的滴定管为___(填“酸式”或“碱式”)滴定管。
(2)该滴定实验滴定终点的现象是___。
(3)步骤二中滴定操作如图所示,正确的操作是___(填编号)。
A. B.
B. C.
C.
(4)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为___mol/L。
(5)若滴定完毕后读数时俯视,则实验误差会__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧已成为夏季空气污染的元凶,地表产生臭氧的机理如图所示,NA代表阿伏加德罗常数的数值。下列说法正确的是( )

A.反应①、②、③都是氧化还原反应
B.16 O3和O2的混合气体,所含质子数为16NA
C.0.5mol NO2溶于水形成1L溶液,可得到0.5 molL1的硝酸溶液
D.标准状况下,11.2L的NO和O2混合气体所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.一定物质的量浓度的Na2S溶液中:2c(Na+)=c(S2-)+c(H2S)+c(HS-)
B.在常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。
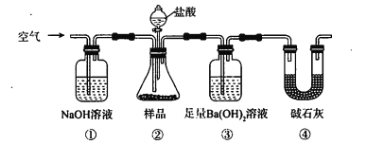
下列说法不正确的是
A. 必须在②③间添加吸收HCl的装置
B. ④的作用是防止空气中的气体影响实验的精确度
C. 通入空气的作用是保证②中产生的气体完全转移到③中
D. 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com